
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
| A.1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:单选题
关于下列各图的叙述正确的是 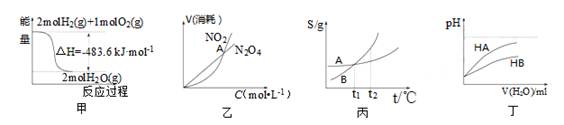
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分析右图的能量变化示意图,下列选项正确的是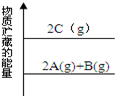
| A.2A+B═2C;△H>O |
| B.2C═2A+B;△H<0 |
| C.2A(g)+B(g)═2C(g)△H>0 |
| D.2A(g)+B(g)═2C(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法正确的是
| A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由“C(石墨)=C(金刚石) ΔH=1.9kJ/mol”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知三个热化学方程式:
(1)I2(g)+H2(g)??2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)??2HI(g) ΔH=+26.48 kJ·mol-1
(3)C(石墨,s)=C(金刚石,s) ΔH>0
下列判断正确的是 ( )。
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| D.金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1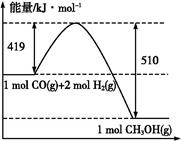 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g)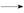 C(g) ΔH,分两步进行:①A(g)+B(g)
C(g) ΔH,分两步进行:①A(g)+B(g) X(g) ΔH1
X(g) ΔH1
②X(g) C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g)
C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g) X(g)的活化能,下列说法正确的是( )
X(g)的活化能,下列说法正确的是( )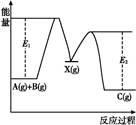
| A.ΔH1=ΔH-ΔH2>0 |
B.X(g)是反应A(g)+B(g)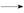 C(g)的催化剂 C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业生产水煤气的反应为:C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是( )。
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l) ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com