

| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
分析 反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此讨论计算.
解答 解:反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,
若剩余的气体为氢气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氧气为2mol×$\frac{1}{3}$=$\frac{2}{3}$mol,故氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,故H2、O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2;
若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氢气为2mol×$\frac{2}{3}$=$\frac{4}{3}$mol,故氢气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,故H2、O2的体积比为$\frac{5}{3}$mol:$\frac{4}{3}$mol=5:4,
所以原来H2、O2的体积比最接近的为②④,
故选B.
点评 本题考查化学方程式的有关计算,题目难度中等,明确左右室的气体的物质的量关系是解答本题的关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
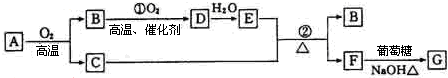
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| B. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液中溶质质量分数为24.5% | |
| C. | 若水的体积与浓硫酸的质量之比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| D. | 若水的质量与浓硫酸的质量比为3:1,稀释后溶液溶质质量分数为24.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 0.1 | C. | 0.5 | D. | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
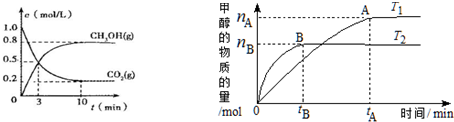
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com