
| A、Fe3+ K+ SO42- NO3- |
| B、Mg2+NH4+ SO42- Cl- |
| C、Na+ K+ SO42- NO3- |
| D、K+ Na+ MnO4- SO42- |


科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将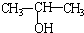 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸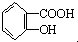 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备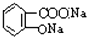 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO、H2的浓度都比原平衡时的要小 |
| B、CO、H2的浓度都比原平衡时的要大 |
| C、H2、H2O(g)的浓度都比原平衡时的要大 |
| D、CO、H2O(g)的浓度都比原平衡时的要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、Cl-、Na+、H+ |
| B、Al3+、K+、OH-、SO42- |
| C、Fe2+、NO3-、SO42-、H+ |
| D、K+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,当弱酸的浓度相同时,电离常数越大,酸性越强 |
| B、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com