
【题目】实验室从海带中提取碘的流程如下:
![]()
(1)写出②中除烧杯外还要用到的玻璃仪器的名称:_______。
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如下图蒸馏实验装置,此装置中的明显错误之处为____________ 、______________。

(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获
得I2的量大 大少于预期,试分析其主要原
因__________________________。
【答案】 分液漏斗 温度计水银球位置不对 冷凝管水的进出方向不对 碘单质易升华,蒸馏时碘蒸汽随四氯化碳蒸出而损失
【解析】试题分析:海带经灼烧后得到海带灰,浸泡海带灰后过滤,得到含碘化物的溶液,向其中通入适量的氯气把碘离子氧化,得到含碘的水溶液,再用四氯化碳萃取、分液后得到碘的四氯化碳溶液,最后蒸馏得到碘。
(1)②中除烧杯外还要用到的玻璃仪器的名称为分液漏斗。
(2)利用蒸馏方法来实现第③步操作,设计了蒸馏实验装置,此装置中的明显错误之处为温度计水银球位置不对、冷凝管水的进出方向不对。
(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获得I2的量大大少于预期,其主要原因是碘单质易升华,蒸馏时碘蒸汽随四氯化碳蒸出而损失。


科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,可能含有Fe3+、K+、Al3+、Mg2+、NH![]() 、Cl-、SO
、Cl-、SO![]() 、HCO
、HCO![]() 、MnO
、MnO![]() 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A. 肯定有Al3+、Mg2+、NH![]() 、Cl- B. 肯定有Al3+、Mg2+、HCO
、Cl- B. 肯定有Al3+、Mg2+、HCO![]()
C. 肯定有K+、HCO![]() 、MnO
、MnO![]() D. 肯定有Al3+、Mg2+、SO
D. 肯定有Al3+、Mg2+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮是广谱高效抗心律失常的药物,它由有机物X经多步反应合成的过程如下:

下列说法正确的是( )
A. 普罗帕酮的分子式为C19H24NO3
B. X,Y的核磁共振氢谱图中都有4组特征峰
C. 含少量X与Y的普罗帕酮可用烧碱溶液进行提纯
D. 一定条件下,X、Y和普罗帕酮都能发生加成、取代、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。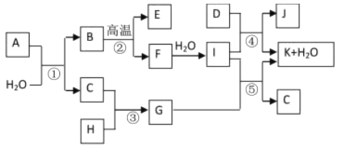
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式____________________________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8 g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量是40 g·mol-1,则生成的二氧化碳的质量是________,将混合气体依次通过氢氧化钠溶液和浓硫酸,最后收集在气球中,气球中收集到的气体其电子总数为__________。(用NA表示阿伏加德罗常数)
(2)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为4A![]() B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
(3)55g铁铝混合物与足量的稀硫酸反应生成标准状况下的氢气44. 8 L,则混合物中铁和铝的物质的量之比为___________。
(4)在100 g物质的量浓度为c mol·L-1,密度为ρ g·cm-3的硫酸中加入一定量的水稀释成 ![]() mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
(5)将20.0 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.25 g·mL-1。该溶液中氢氧化钠的物质的量浓度为___________,质量分数为__________,从该溶液中取出10 mL,将其加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为__________,将一定体积的原溶液和稀释后的溶液按1∶4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.只有活泼金属与活泼非金属间才能形成离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com