
分析 该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、氯化铁发生还原反应,根据原电池原理知,Cu为负极、不如Cu活泼的金属或导电的非金属性作正极,氯化铁溶液为电解质溶液,据此设计原电池.
解答  解:该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、氯化铁发生还原反应,根据原电池原理知,Cu为负极、不如Cu活泼的金属或导电的非金属性作正极,氯化铁溶液为电解质溶液,可以选取石墨作正极,电极及电池反应式分别为负极:Cu-2e-=Cu2+、正极:2Fe3++2e-=2Fe2+、总反应:2Fe3++Cu=Cu2++2Fe2+,装置图为
解:该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、氯化铁发生还原反应,根据原电池原理知,Cu为负极、不如Cu活泼的金属或导电的非金属性作正极,氯化铁溶液为电解质溶液,可以选取石墨作正极,电极及电池反应式分别为负极:Cu-2e-=Cu2+、正极:2Fe3++2e-=2Fe2+、总反应:2Fe3++Cu=Cu2++2Fe2+,装置图为 ,
,
故答案为:负极:Cu-2e-=Cu2+;正极:2Fe3++2e-=2Fe2+; .
.
点评 本题考查原电池设计,为高频考点,明确原电池原理是解本题关键,根据电池反应式中元素化合价变化确定正负极及电解质溶液,发生氧化反应的金属作负极、发生还原反应的电解质为原电池中电解质.


科目:高中化学 来源: 题型:解答题
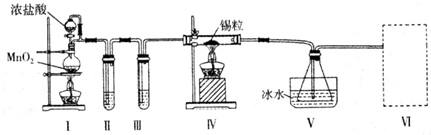
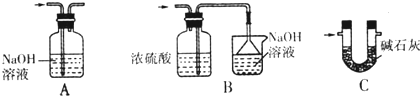
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量:②>①>③ | B. | 氢原子数:②>①>③ | C. | 体积:②>①>③ | D. | 密度:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
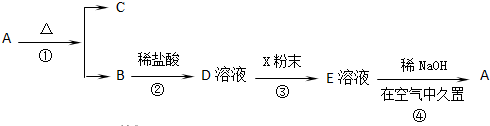
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨能使钢铁更容易发生电化学腐蚀 | |
| B. | 钢铁在潮湿的地窑中较易发生析氢腐蚀 | |
| C. | 铁锈的主要成分是Fe2O3•nH2O | |
| D. | 钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na、Mg分别与冷水反应的实验来证明Na、Mg的金属性强弱 | |
| B. | 用MgCl2和AlCl3分别与过量氨水反应的实验证明Mg、Al的金属性强弱 | |
| C. | 用MgCl2和AlCl3分别与过量NaOH溶液逐步反应的实验证明Mg、Al的金属性强弱 | |
| D. | 用Mg(OH)2和Al(OH)3分别与强碱反应的实验来证明Mg、Al的金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com