
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
⑴配制(NH4)2Fe(SO4)26H2O溶液时,需加少量稀硫酸,目的是 。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三4月双周练习化学试卷(解析版) 题型:填空题
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
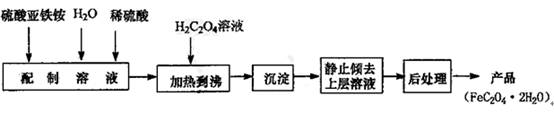
⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是
。
6H2O溶液时,需加少量稀硫酸,目的是
。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
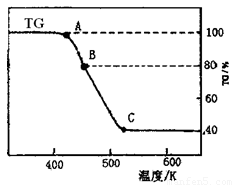
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)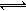 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
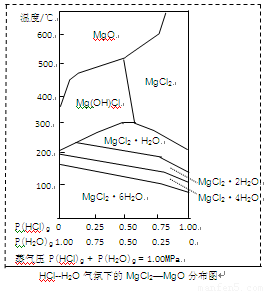
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高考化学模试试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com