
【题目】高分子材料 M 在光聚合物和金属涂料方面有重要用途,M 的结构简式为

工业上合成 M 的过程可表示如下:

已知:A 完全燃烧只生成 CO2 和 H2O,其蒸汽密度是相同状况下氢气密度的 43 倍,分子中 H、O 原子个数比为 3∶1,它与 Na 或 Na2CO3 都能反应产生无色气体。
(1)B 的结构简式是_____。
(2)A 中所含官能团的名称是_____。
(3)下列说法正确的是_____(填字母)。
a 工业上,B 主要通过石油分馏获得
b C 的同分异构体有 3 种(不包括 C)
c E→M 的反应是缩聚反应
(4)写出 A+D+H3PO4→E 反应的化学方程式:_____。
(5)F 是 A 的一种同分异构体,F 的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:
![]()
ⅰ、写出 F、N 的结构简式 F:_____;N:_____。
ⅱ、写出反应①的化学方程式_____。
【答案】CH2=CH-CH3 碳碳双键、羧基 b  OHC-CH2-CH2-CHO
OHC-CH2-CH2-CHO 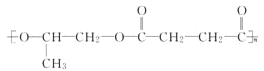 OHC-CH2-CH2-CHO+4[Ag(NH3)2]OH
OHC-CH2-CH2-CHO+4[Ag(NH3)2]OH![]() H4NOOC-CH2-CH2-COONH4+6NH3+2H2O+4Ag
H4NOOC-CH2-CH2-COONH4+6NH3+2H2O+4Ag
【解析】
B为分子式为C3H6,能与溴发生加成反应,则B为CH3CH=CH2,C为CH3CHBrCH2Br,C发生水解反应生成D为![]() .A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,Mr(A)=43×2=86,分子中H、O原子个数比为3:1,它与Na或Na2CO3都能反应产生无色气体,说明分子中含有羧基,D与A、H3PO4反应得到E,E转化得到M,结合M的结构简式可知,A为
.A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,Mr(A)=43×2=86,分子中H、O原子个数比为3:1,它与Na或Na2CO3都能反应产生无色气体,说明分子中含有羧基,D与A、H3PO4反应得到E,E转化得到M,结合M的结构简式可知,A为![]() ,E为
,E为 ,(5)中F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子,且能发生银镜反应,说明分子中含有-CHO,则F为OHC-CH2-CH2-CHO,被氧化生成H为HOOC-CH2-CH2-COOH,H与D发生缩聚反应生成高聚物N,则N为
,(5)中F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子,且能发生银镜反应,说明分子中含有-CHO,则F为OHC-CH2-CH2-CHO,被氧化生成H为HOOC-CH2-CH2-COOH,H与D发生缩聚反应生成高聚物N,则N为 ,据此解答。
,据此解答。
(1)由上述分析可知,B的结构简式为CH3CH=CH2;
(2)由上述分析可知,A为![]() ,含有官能团为:碳碳双键、羧基;
,含有官能团为:碳碳双键、羧基;
(3)a.B为CH3CH=CH2,应通过石油的裂化获得,故a错误;
b.C为CH2BrCHBrCH3,对应的同分异构体有CHBr2CH2CH3、CH3CBr2CH3、CH2BrCH2CH2Br3种(不包括C),故b正确;
c.E→M的反应是加聚反应,故c错误;
故答案为:b;
(4)A+D+H3PO4--E反应的化学方程式为: ,该反应类型是:酯化反应;
,该反应类型是:酯化反应;
(5)ⅰ.F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子,且能发生银镜反应,说明分子中含有-CHO,应为OHC-CH2-CH2-CHO,被氧化生成H为HOOC-CH2-CH2-COOH,可与D发生缩聚反应生成N,为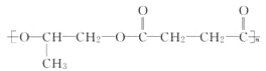 ;
;
ⅱ.反应①的化学方程式为:OHC-CH2-CH2-CHO+4[Ag(NH3)2]OH![]() H4NOOC-CH2-CH2-COONH4+6NH3+2H2O+4Ag。
H4NOOC-CH2-CH2-COONH4+6NH3+2H2O+4Ag。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝粉末混合物投入一定浓度的200 mL盐酸中,使合金全部溶解,向所得溶液中滴加5.0 mol·L-1的NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积的关系如图所示。
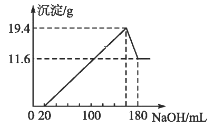
(1)原合金中铝的物质的量分数为_____________。
(2)盐酸中HCl的物质的量浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式为
(1)用系统命名法命名该烃:______________________。
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构有____种(不包括立体异构,下同)。
(3)若该烷烃是由炔烃加氢得到的,则原炔烃的结构有____种。
(4)该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有____种。
(5)写出由苯丙烯(![]() )在催化剂作用下生成聚苯丙烯的反应方程式:_____________。
)在催化剂作用下生成聚苯丙烯的反应方程式:_____________。
(6)写出由甲苯制取TNT的反应方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 X、Y、Z、W 的转化关系如图所示。下列说法错误的是( )

A.满足上述反应的 X 有五种B.Z 能发生取代反应
C.W 一定能使 Br2 的 CCl4 溶液褪色D.Y 含有两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
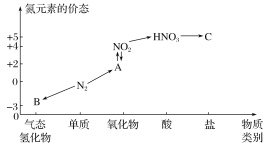
(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:

将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为__________________________________________.
②中离子方程式为__________________________________________________.
(2)①中长导管的作用是________________________________________________.
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用__________________________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是__________________________________________________________.
比较两套装置,装置Ⅱ的主要优点是______________________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com