
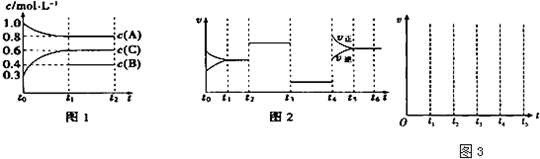
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| △c |
| △t |
| 0.2mol |
| 2L?2min |
| P平衡 |
| P起始 |
| n平衡 |
| n起始 |
| 1.8mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、①②③ | B、④⑤⑥ |
| C、①③⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
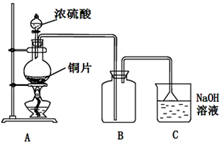 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 溶液变成黄色 |
| 步骤2: |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) |
改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:
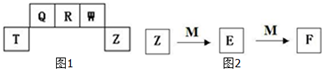 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
60 27 |
60 27 |
| A、是一种核素 | ||
| B、质子数是60 | ||
C、与
| ||
| D、中子数是33 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com