
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;根据价层电子对互斥理论确定该分子的空间构型;
(2)根据价层电子对互斥理论确定N原子轨道杂化类型;原子个数相等、价电子数相等的微粒为等电子体,等电子体结构相似,O22+和N2分子为等电子体,其结构和N2结构相似,根据氮气分子结构计算1mol O22+中含有的π键数目;
(3)Cr元素的原子序数是24号元素,其原子核外有24个电子,Cr3+核外电子数是21,根据构造原理书写其基态核外电子排布式;
(4)根据分子中中心原子的价层电子对数判断分子的空间构型;
(5)分子中正负电荷中心不重合,这样的分子为极性分子;分子中正负电荷的重心重合,则为非极性分子.
解答 解:A.(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以这三种元素第一电离能大小顺序是:F>N>O;
OF2分子中O原子价层电子对个数=2+$\frac{1}{2}$=4,且含有2个孤电子对,所以其空间构型为V形,
故答案为:F>N>O;V形;
(2)NO2+离子中氮原子价层电子对个数=2+$\frac{1}{2}$(5-1-2×2)=2,所以为sp杂化;
O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有两个π键,则1mol O22+中含有的π键数目为2NA;
故答案为:sp;2NA;
(3)Cr元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理其核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(4)O3分子的结构如图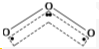 ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形;
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形;
A.H2O中含有2对σ键,2对孤电子对,O原子sp3杂化,空间结构为V形,故A错误;
B.CO2为含有4个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故B错误;
C.SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,故C正确;
D.BeCl2含有2个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故D错误;
故答案为:C;
(5)O3中的中心O原子为sp2杂化,理想模型为平面三角形,分子构型为V型,而且O3形成的是三中心四电子大π键,空间构型不对称.正负电荷重心不重合,所以是极性分子,
故答案为:是.
点评 本题考查了物质结构,涉及杂化轨道理论、空间构型的判断、核外电子排布等知识点,旨在考查学生灵活运用基础知识解决实际问题的能力,注意杂化理论的熟练应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | dcab | B. | dabc | C. | dbca | D. | dbac |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4与CH4的空间构型和键角都相同 | |
| B. | O3与OF2都是V形分子 | |
| C. | SO3和SeO32-的立体构型都是三角锥形 | |
| D. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物X的键线式为
.有机物X的键线式为 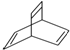 ,下列说法正确的是( )
,下列说法正确的是( )| A. | X的化学式为C8H10 | |
| B. | 有机物Y  与X互为同系物 与X互为同系物 | |
| C. | X因发生加成反应而使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状烃Z,Z的一氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加明矾使海水中的盐分沉淀而淡化 | |
| B. | 利用太阳能使海水蒸馏淡化 | |
| C. | 将海水缓慢凝固以获取淡化的饮用水 | |
| D. | 将海水通过离子交换树脂,以除去所含离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、HCO3- | B. | Cu2+、Mg2+、SO42-、NO3- | ||
| C. | Na+、K+、ClO-、SO42- | D. | Fe3+、K+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出 | |
| B. | 中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度 | |
| C. | 用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量 | |
| D. | 用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com