
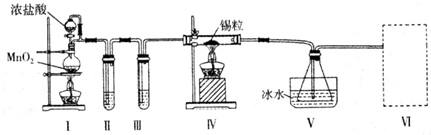
分析 根据图及实验目的知,I是制备氯气,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,浓盐酸具有挥发性,水易挥发,所以得到的氯气中含有HCl、水,SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,为防止生成的氯化物水解和产生杂质,应该用干燥纯净的氯气,所以II是吸收氯化氢、III是干燥氯气;
IV中反应生成SnCl4,SnCl4的沸点较低,所以V降低温度得到SnCl4液体;VI中物质要吸收尾气且能干燥空气;
(1)试管II目的是除去氯化氢;
(2)SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,应避免空气中成分进入装置Ⅴ且能吸收尾气;
(3)回收利用装置I中未反应完的MnO2,二氧化锰难溶于水用过滤操作回收,应该采用过滤方法;
(4)甲同学认为V中产品可能含有SnCl2,检测产品中是否存在SnCl2,可以利用其还原性设计实验验证;
(5)过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,结合原子守恒和电荷守恒写出离子方程式;
根据n=cV计算反应中消耗的K2Cr2O7的物质的量;根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:根据图及实验目的知,I是制备氯气,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,浓盐酸具有挥发性,水易挥发,所以得到的氯气中含有HCl、水,SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,为防止生成的氯化物水解和产生杂质,应该用干燥纯净的氯气,所以II是吸收氯化氢、III是干燥氯气;
IV中反应生成SnCl4,SnCl4的沸点较低,所以V降低温度得到SnCl4液体;VI中物质要吸收尾气且能干燥空气;
(1)分析装置Ⅰ是制备氯气的发生装置,生成的氯气中含有氯化氢和水蒸气,需要除杂,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,进入装置Ⅳ和锡反应生成SnCl4,故答案为:饱和食盐水;
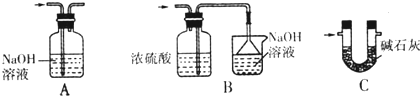
(2)SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,应避免空气中成分进入装置Ⅴ,
A装置可以吸收剩余气体,但不能保证水蒸气进入装置Ⅴ,B装置不能吸收剩余氯气,装置C可以吸收水蒸气和二氧化碳,能避免空气中二氧化碳和水蒸气进入装置Ⅴ,故选C,
故答案为:C;
(3)回收利用装置I中未反应完的MnO2,二氧化锰难溶于水用过滤操作回收,结合过滤装置选择需要的仪器为:普通漏斗、玻璃棒、烧杯,
故答案为:普通漏斗、玻璃棒、烧杯;
(4)甲同学认为V中产品可能含有SnCl2,检测产品中是否存在SnCl2,可以利用其还原性设计实验验证,取适量溴的四氯化碳溶液向其中加入足量的产品振荡,溶液颜色褪去,则证明含有SnCl2,否则不含,
故答案为:取少量V中产品溶于水,滴加少量Br2的四氯化碳溶液,溶液颜色褪去;
(5)第二步:过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,反应的离子方程式为:2Fe3++Sn2+=2Fe2++Sn4+,反应中消耗的K2Cr2O7的物质的量为1.0mol/L×0.020L=0.02mol,
根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
故n(Sn)=3n(K2Cr2O7)=3×0.02mol=0.06mol,
Sn的质量为:0.06mol×119g/mol=7.14g,
试样中Sn的百分含量为$\frac{7.14g}{7.5g}$×100%=95.2%,
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;95.2%.
点评 本题考查物质制备,为高频考点,侧重考查学生实验基本操作、计算、分析判断能力,涉及方程式的计算、氧化还原反应、实验基本操作等知识点,正确获取信息并灵活运用信息解答问题是解本题关键,注意流程图中发生的反应,题目难度中等.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| B. | 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| C. | 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| D. | 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属的单质和化合物在火焰上灼烧时都能显现特殊的颜色,因此焰色反应是元素的性质 | |
| B. | 钾的焰色为紫色,必须通过蓝色钴玻璃才能观察到 | |
| C. | 焰色反应是物理过程,但也可能伴随着化学变化 | |
| D. | 烟花能显现出五颜六色,与烟花中含有某些金属元素的盐类有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)
(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子数目是0.4NA | |
| C. | 1mol Cl2,与H2O反应转移NA个电子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液是中性 | |
| B. | 中性溶液中一定有c(H+)=1.0×10-7mol•L-1 | |
| C. | 在100℃时,纯水的pH<7,因此显酸性 | |
| D. | c(OH-)=c(H+)的溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com