
【题目】(1)已知反应2H2 + O2 ![]() 2H2O为放热反应,破坏1mol的化学键消耗的能量称为化学键的键能。有关物质中化学键的键能如下表,则生成1mol水可以放出热量 __________kJ
2H2O为放热反应,破坏1mol的化学键消耗的能量称为化学键的键能。有关物质中化学键的键能如下表,则生成1mol水可以放出热量 __________kJ
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示,A、B两个电极均由多孔的碳块组成。
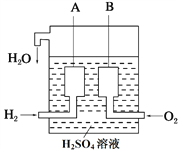
①B作_____极材料(填“正”或“负”),电解质溶液中SO42- 移向_____极(填“A”或“B”)。
②写出A极的电极反应式_______,一段时间后,溶液的PH______(填“升高”“降低”“不变”),
③如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,当有标准状况下11.2L CH4完全反应时,导线中通过的电子的数目__________。
【答案】 242 正 A H2-2e-=2H+ 升高 4NA
【解析】(1)考查键能与热量的关系,断裂2molH-H键吸收热量是2×436kJ=872kJ,断裂1molO=O键吸收热量为496kJ,共吸收热量为1368kJ,生成4molH-O键,放出热量为4×463kJ=1852kJ,因此净放出热量为(1852-1368)kJ=484kJ,即生成1molH2O放出的热量为484/2kJ=242kJ;(2)考查原电池的工作原理和电极反应式的书写,①通氧气一极为正极,即B为正极,A为负极,根据原电池的工作原理,阴离子向负极移动,即SO42-向A极移动;②电解质为硫酸,A极反应式为H2-2e-=2H+,正极反应式为O2+4H++4e-=2H2O,电池总反应是2H2+O2=2H2O,对硫酸起到稀释作用,c(H+)降低,因此溶液的pH升高;③CH4转化成CO2,因此转移电子物质的量为11.2×8/22.4mol=4mol,即转移电子数为:4NA。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到环状化合物G,G的实验式为C2H3O,相对分子质量为172,核磁共振氢谱显示只有一个吸收峰。

已知:
请回答下列问题:![]()
(1)写出G的分子式:_______________。
(2)写出A的结构简式:______________________。
(3)写出F→G反应的化学方程式: ____________,该反应属于________(填反应类型)。
(4)C的同分异构体有多种。
①属于芳香族化合物,且能发生水解反应的有_____种;
(5)F可以发生下列变化:
![]()
J的结构简式是_________________,由F可以直接生成H,设计反应①和②的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C. 放热反应都不需要加热就能发生
D. 吸热反应在一定条件(如常温、加热等)下也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料:NaNO2有毒,溶液显碱性,NaNO2有较强的氧化性和较弱的还原性。国家规定肉制品中NaNO2含量不能超过30 mg/kg。
(1)NaNO2溶液显碱性的原因是_____________________。(用离子方程式表达)
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是_________。(填化学式)。
活动三:检测熟肉中NaNO2含量的变化
(3)分别从 1000 g刚煮熟的肉和 1000 g隔夜熟肉中提取NaNO2,配成溶液,再分别用0.00500 mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00 mL,隔夜熟肉消耗16.00 mL。(提示:MnO4一转化为Mn2+,NO2一转化为NO3一)
① 在做该滴定实验时需要用到的实验仪器有___________
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
② 滴定终点的判断依据为_________________ 。
③隔夜熟肉中NaNO2的含量是____________mg/kg (保留三位有效数字),该数据说明保存得当的隔夜熟肉_________(选填“能”或“不能” )食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮(C3H60)通常是无色液体,易溶于水,密度小于1g/mL,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.溴化银是一种重要的感光材料,是胶卷中的核心成分之一
B.硅晶体是一种重要的半导体材料,还可用于制造光导纤维
C.镁燃烧发出耀眼的白光,常用于制造信号弹和焰火
D.硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期VA族。D、E、H均为难溶于水的白色固体:化合物C、E均含A元素。其余物质均为中学化学中常见物质。

请回答:
(1)写出H的化学式:________________。
(2)化合物A3M4中含有的化学键类型为:________________。
(3)写出反应②的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com