
| A. | 红褐色溶液物质是Fe(OH)3胶体,气泡的成分是H2 | |
| B. | 红褐色沉淀是Fe(OH)3沉淀,黑色的物质是Fe | |
| C. | 除去红褐色溶液中少量沉淀的实验方法是参析 | |
| D. | 由于Fe3+在溶液中被水分子包围形成[Fe(H2O)4]3+,不利于铝粉与Fe3+的接触反应,所以只生成少量的单质铁 |
分析 氯化铁是强酸弱碱盐,水解呈酸性,水解反应方程式为:Fe3++3H2O?Fe(OH)3+3H+,加入铝粉产生气泡,说明2Al+6HCl=2AlCl3+3H2↑,氢离子浓度减小,使水解平衡右移,生成Fe(OH)3沉淀,并有少量的能被磁铁吸引的黑色沉淀物质生成,说明生成单质铁,由此分析解答.
解答 解:A、看到溶液变成红褐色,是Fe(OH)3胶体,气泡是2Al+6HCl=2AlCl3+3H2↑产生氢气,故A正确;
B、氢离子浓度减小,使水解平衡右移,生成Fe(OH)3沉淀,能被磁铁吸引的黑色沉淀物质生成,说明生成单质铁,故B正确;
C、除去红褐色溶液中少量沉淀的实验方法是过滤,故C错误;
D、要想充分反应,必须充分接触,而铁离子与水分子之间形成水合铁离子,不利于铝粉与Fe3+的接触反应,所以反应不完全,只能生成少量的铁,故D正确;
故选:C.
点评 本题考查氯化铁的性质,氯化铁是强酸弱碱盐水解溶液呈酸性且铁离子具有极强的氧化性,与铝发生氧化还原反应生成单质铁,有一定的难度.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
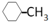 +H2
+H2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

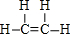 ;B的结构简式:CH3CH3;
;B的结构简式:CH3CH3;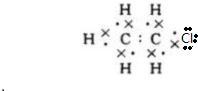 ;D的官能团名称羟基;G官能团的结构简式-COOH.
;D的官能团名称羟基;G官能团的结构简式-COOH.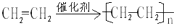 (反应类型加聚反应).
(反应类型加聚反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: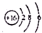 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 分离出HI | C. | 充入H2 | D. | 充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
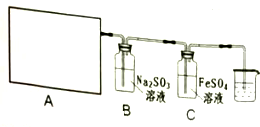
| 实验目的 | 操作与结论 |
| ①FeSO4溶液完全未被氧化 | 实验①取少许溶液于试管中,滴入数滴KSCN溶液,若溶液不变色(选填“不变色”或“变红色”),说明溶液完全未被氧化. |
| ②FeSO4部分被氧化 | ②实验②:取少许溶液于试管中,滴入数滴酸性KMnO4溶液,若溶液褪色;再另取少许溶液于试管中,滴加几滴KSCN溶液,溶液变 红(血红)色,说明溶液被部分氧化. |
| ③FeSO4完全被氧化 | ③重复实验②在待测②液中滴加数滴酸性KMnO4溶液后,溶液不褪色,另一实验现象与②同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com