
| A. | 食盐熔化 | B. | 氯化氢溶于水 | C. | 干冰气化 | D. | 金属钠熔化 |
科目:高中化学 来源: 题型:解答题
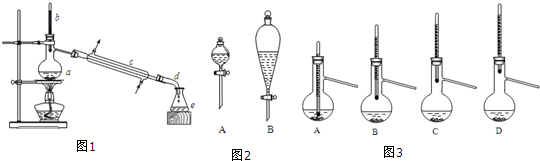
| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次减少 | |
| B. | C、N、O元素非金属性依次增强 | |
| C. | C、N、O元素最高正价依次增大 | |
| D. | Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;物质⑤的结构式O=C=O.
;物质⑤的结构式O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | ZnO是还原产物 | |
| C. | 氧化产物只有N2 | |
| D. | 该反应每生成1mol N2转移5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com