
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A. 半导体材料砷化镓 B. 透明陶瓷材料硒化锌
C. 吸氢材料镧镍合金 D. 超导材料K3C60
科目:高中化学 来源: 题型:
【题目】25℃时,将 0.10 molL-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:

下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
锂一磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有
个空间运动状态。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有的π键的数目
为____________________。
(6)铜晶体密堆积方式如图所示,铜原子的配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式________________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾.氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等.工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得.
某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝.

(1)A装置中发生反应的离子方程式为_____________________________;
(2)B、C装置中应盛放的试剂分别为______、______;
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,对实验产生的不良后果是___.
(4)F装置所起的作用______.
Ⅱ. 有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32﹣、SO42﹣等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图1所示:

(1)在原溶液中一定存在的离子有______;
(2)第③实验中,若取原溶液100mL,滴加NaOH溶液的物质的量浓度为0.5molL﹣1 ,且生成沉淀的量与加入NaOH 的量如图2所示,则该溶液中所含阳离子的浓度为_____molL﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛是常用的一种食用香精。存在下列转化关系:
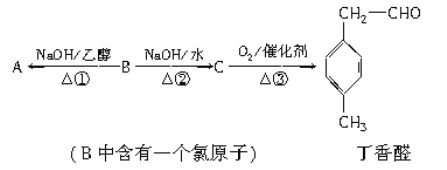
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的说法中正确的是
A. IA族元素都是碱金属元素
B. 碱金属单质可将铜从其盐溶液中置换出来
C. 金属钾具有强还原性,K+具有强氧化性
D. Cs常温下与水反应会发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CCl4的沸点低于SiCl4,其原因是晶体类型不同
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是共价化合物
C. HClO易分解是因为HClO分子间作用力弱
D. 离子化合物中不一定含有金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com