
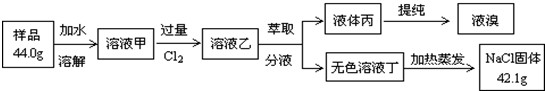
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
分析 (1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(2)漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,碳酸钙不溶于水,加入盐酸,次氯酸具有漂白性,可使品红褪色.
解答 解:(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(2)①漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,则漂白粉未变质,只含Ca(ClO)2,漂白粉全部变质,只含CaCO3,漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3.
故答案为:Ca(ClO)2;
②可加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中,若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立;
取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡,若品红褪色结合实验①中的现象和结论b,则假设3成立;若品红不褪色,则假设2成立.
故答案为:
| 实验步骤 | 预期现象和结论 | |
| ① | a.若澄清石灰水未见浑浊,则假设1成立; b.若澄清石灰水变浑浊,则假设2或假设3成立 | |
| ② | 假设3 | |
点评 本题易氯气为载体考查性质实验,侧重于学生的实验能力的考查,为高考常见题型和高频考点,难度大不,注意把握物质的性质以及实验原理.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、ClO- | B. | K+、NO3-、Cl-、CO32- | ||
| C. | NH4+、Ca2+、OH-、HCO3- | D. | Al3+、NO3-、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
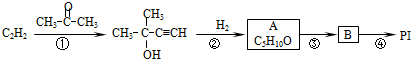
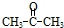 ”改为“乙醛”,经过②③④后得到产物的结构简式是
”改为“乙醛”,经过②③④后得到产物的结构简式是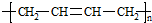 .
.

 +n NaOH→
+n NaOH→ +n CH3COONa.
+n CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处| A. | 反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 | |
| B. | 溶液中(A2+)减小 | |
| C. | y电极上有H2产生,发生还原反应 | |
| D. | B的电极反应:B-2e═B2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com