
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
【答案】C
【解析】A.图示可以看出其中含有HFeO4-,向pH=5的高铁酸盐溶液中加入KOH溶液生成FeO42-,则HFeO4-和KOH溶液之碱反应,即HFeO4-+OH-=FeO42-+H2O,故A正确;B.pH≥9时,FeO42-含量接近100%,则为获得尽可能纯净的高铁酸盐,pH应控制pH≥9,故B正确;C.根据H3FeO4+ 的电离常数分析,其电离平衡常数K2=c(HFeO4 -)c(H +)/c(H2FeO4)=4.8×10-4,则当溶液中pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=4.8×10 -4/10 -4=4.8,故C错误;D.由图象纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>C(HFeO4-),故D正确。故选:C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g) ![]() 2HCl(g)反应的能量变化示意图如下:
2HCl(g)反应的能量变化示意图如下:

下列说法正确的是
A. 点燃条件和光照条件下,反应的ΔH不同
B. 反应的ΔH约为[2c- (a+b)]kJ·mol-1
C. “假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D. 反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) ![]() 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融) ![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是

A. 电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
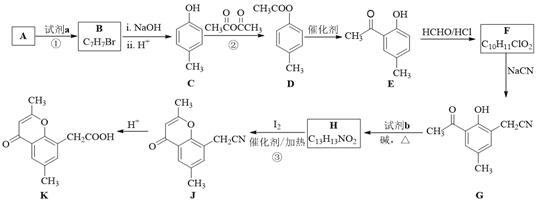
已知部分有机化合物转化的反应式如下:
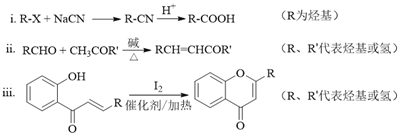
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)C→D的化学方程式是______。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:______。
a.能发生银镜反应
b.分子中含有酯基
c. 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是______;试剂b是______。
(5)H与I2反应生成J和HI的化学方程式是______。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线。_____________
),参照下列模板写出相应的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:
①在酸性环境下,Cr(VI)通常以Cr2O72-的形式存在,Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
②Cr2O72-的氧化能力强于CrO42-
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI)。下列关于焦炭的说法正确的是________(填字母序号)。
a. 作原电池的正极 b. 在反应中作还原剂 c. 表面可能有气泡产生
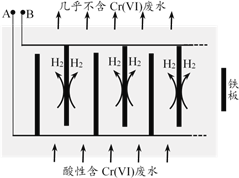
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如右图所示。
(2)A极连接电源的________极,A极上的电极反应式是________。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-=H2↑,此外还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为________。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如右图所示。

①由图知,电解还原法应采取的最佳pH范围为________。
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
②解释曲线I和曲线IV去除率低的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:锌与浓硫酸共热除生成二氧化硫气体外,还可能产生氢气;在加热的条件下二氧化硫可被CuO氧化。为验证该反应的气体产物及性质,设计了如下图所示的实验装置(设锌与浓硫酸共热时产生的气体为X)。

(1)上述装置的连接顺序为:气体X→A→____→A→ → → →D;
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为_______________________________________;
(3)装置 C中的NaOH溶液能用下列____代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是____________________________
(4)气体X中可能含有H2的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13 mol·L-1
B. 所得溶液中由水电离产生的c(H+)=1.0×10-13 mol·L-1
C. 所加的烧碱溶液pH=13.0
D. 所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com