
纯水在25℃和80℃时的氢离子浓度,前者和后者的关系是( )
|
| A. | 前者大 | B. | 相等 | C. | 前者小 | D. | 不能肯定 |
考点:
水的电离.
专题:
电离平衡与溶液的pH专题.
分析:
Kw是水的离子积常数,常温下,Kw=c(H+)×c(OH﹣)═1×10﹣14,水电离出的c(H+)=c(OH﹣)═1×10﹣7mol/L;其pH=7;水的电离是吸热过程,温度升高促进电离,80℃时水中氢离子和氢氧根离子浓度增大,所以纯水pH<7.
解答:
解:Kw是水的离子积常数,常温下,kw=c(H+)×c(OH﹣)═1×10﹣14,水电离出的c(H+)=c(OH﹣)═1×10﹣7mol/L,其pH=7;
水的电离是吸热过程,温度升高促进电离,80℃时水中氢离子和氢氧根离子浓度大于25℃时水中氢离子和氢氧根离子浓度,
所以前者小于后者;
故选C.
点评:
本题考查了水的电离平衡的影响因素分析和PH计算,注意水的电离过程是吸热过程,题目较简单.


科目:高中化学 来源: 题型:
下列有关物质的用途的叙述正确的是( )
|
| A. | 可用铝制容器盛装稀硫酸 |
|
| B. | Na2O2可用于呼吸面具中作为氧气的来源 |
|
| C. | FeO常用于制造红色油漆和涂料 |
|
| D. | SiO2可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 单体的质量之和就是所生成高聚物的质量 |
|
| B. | 单体是一种物质时发生加聚反应 |
|
| C. | 缩聚反应的单体只有一种 |
|
| D. | 淀粉和纤维素因聚合度不同所以他们不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
酚醛树脂可用苯酚和甲醛反应制得.实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出酚醛树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将酚醛树脂取出.在上述两种情况下,下列有关叙述正确的是( )
|
| A. | 酸性条件制得的是体型结构酚醛树脂,碱性条件制得的是线型结构酚醛树脂 |
|
| B. | 酸性条件制得的是线型结构酚醛树脂,碱性条件制得的是网状结构酚醛树脂 |
|
| C. | 两种条件下制得的都是线型结构的酚醛树脂 |
|
| D. | 两种条件下制得的都是网状结构酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在0.1mol•L﹣1 CH3COOH溶液中,水的离子积是( )
|
| A. | 1×10﹣14 | B. | 1×10﹣13 | C. | 1.32×10﹣14 | D. | 1.32×10﹣15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是弱电解质的是( )
|
| A. | 熔化时不导电 |
|
| B. | 水溶液的导电能力很差 |
|
| C. | 不是离子化物,而是极性共价化合物 |
|
| D. | 溶液中已电离的离子和未电离的分子共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol•L-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是
(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
 |
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
① 此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
② 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③ 产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
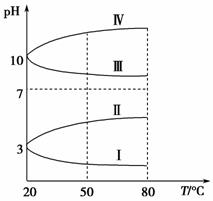
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
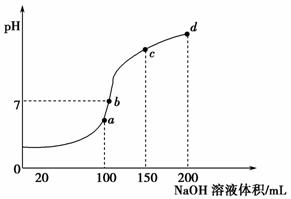
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com