
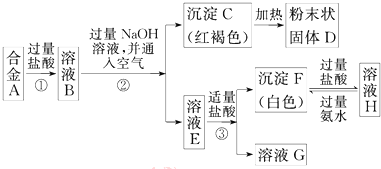
分析 已知合金A由两种常见金属组成,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液丙通入空气,过滤得到红褐色沉淀,判断为Fe(OH)3,加热分解得到粉末状固体D为氧化铁,则确定原来金属有Fe,滤液E加入少量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为氢氧化铝沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G为偏铝酸钠和氯化钠的混合溶液,溶液E为NaAlO2溶液,溶液B为氯化亚铁和氯化铝的混合溶液,金属为Fe,Al,据此分析回答问题.
解答 解:已知合金A由两种常见金属组成,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液丙通入空气,过滤得到红褐色沉淀,判断为Fe(OH)3,加热分解得到粉末状固体D为氧化铁,则确定原来金属有Fe,滤液E加入少量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为氢氧化铝沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G为偏铝酸钠和氯化钠的混合溶液,溶液E为NaAlO2溶液,溶液B为氯化亚铁和氯化铝的混合溶液,金属为Fe,Al,
(1)过程②中分离C红褐色沉淀和E为NaAlO2溶液的化学实验基本操作是过滤,故答案为:过滤;
(2)H溶液为过量盐酸和AlCl3溶液,溶液中所含的阳离子有Al3+,H+,故答案为:Al3+,H+;
(3)D为氧化铁,Fe2O3与合金中的一种金属粉末均匀混合,在高温下反应可生成铁,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查了无转化关系分析,物质性质的分析应用,主要是反应现象的理解,掌握物质性质和反应特征现象是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸发时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 过滤时,要用蒸馏水浸没沉淀2-3次,以除去可能附着在沉淀上的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
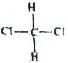 和
和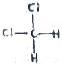
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com