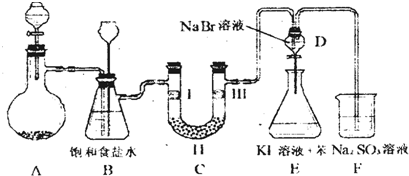
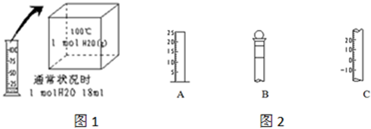
分析:Ⅰ(1)在标况下,气体摩尔体积为22.4L/mol,保持压强不变,温度越高,气体摩尔体积的值越大;
(2)根据质量守恒定律的内容可知,在化学反应前后肯定没有发生变化的是:物质的总质量、元素的种类、原子的种类和原子的数目;
Ⅱ(1)根据常见计量仪器的结构特征分析.
(2)根据仪器B的构造和用途来分析;
(3)根据仪器B的结构特点来分析查漏的方法;
Ⅲ(1)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)A、带塞子或带活塞的容器,使用前要查漏;
B.容量瓶不能润洗;
C.氢氧化钠固体的称量要放在烧杯里;
D.容量瓶不能用于稀释浓溶液;
E.摇匀的操作是:定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀.
(3)先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C
浓V
浓=C
稀V
稀来计算;根据需要的浓硫酸的体积来选择合适的量筒.
解答:
解:Ⅰ(1)在标况下,气体摩尔体积为22.4L/mol,保持压强不变,温度越高,气体摩尔体积的值越大,故当在100℃时,气体摩尔体积的数值大于22.4L/mol,即1mol水蒸气的体积大于22.4L,故答案为:>;
(2)质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.再根据其意义:元素的种类、原子的数目、原子的种类在反应前后不变.由此可知:在该反应中,物质的总质量、原子数目在反应前后不会发生变化,分子数目和物质的种类在反应前后发生了变化,故选:BC;
Ⅱ(1)A无0刻度,从下到上刻度逐渐增大,应为量筒,B有活塞,且只有一个刻度线,应为容量瓶,C刻度有负值,应为温度计,故答案为:量筒;容量瓶;温度计;
(2)B为容量瓶,为配制一定物质的量浓度的溶液的计量仪器,只能在常温下使用,不能用来盛装过冷或过热的液体,则标有温度,实验室有有不同规格的容量瓶,不同规格的容量瓶可盛装不同体积的液体,则容量瓶中标有溶剂,且只有一个刻度,故答案为:②③⑤;
(3)容量瓶有塞子,查漏的方法:往容量瓶中加入少量水,塞好瓶塞,用食指摁住瓶塞,另一只手托住瓶底,将容量瓶倒立,观察瓶塞周围是否有水漏出.如果不漏水,再将容量瓶正立旋转瓶塞180°,重复上述操作,
故答案为:往容量瓶中加入少量水,塞好瓶塞,用食指摁住瓶塞,另一只手托住瓶底,将容量瓶倒立,观察瓶塞周围是否有水漏出.如果不漏水,再将容量瓶正立旋转瓶塞180°,重复上述操;
Ⅲ(1)①定容时俯视刻度线观察液面,会导致溶液体积偏小,则浓度偏高,故①选;
②若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故②不选;
③定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,若再加蒸馏水补至刻度线则会使溶液浓度偏低,故③不选;
④用量筒;取浓硫酸时仰视读数会使浓硫酸的体积偏大,则所配溶液的浓度偏高,故④选.
故选①④;
(2)A、带塞子或带活塞的容器,使用前要查漏,故使用容量瓶前检查它是否漏水,故A正确;
B.容量瓶不能用待配液润洗,故B错误;
C.氢氧化钠固体不能放在滤纸上称量,要放在烧杯里,故C错误;
D.容量瓶不能用于稀释浓溶液,故不能将18.4mol?L
-1的硫酸直接导入容量瓶,故D错误;
E.定容后摇匀的操作方法:定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故E正确;
故选BCD.
(3)浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设需要的浓硫酸的体积为Vml,
根据溶液稀释定律C
浓V
浓=C
稀V
稀可知:18.4mol/L×Vml=100mL×1.0mol?L
-1 解得V=5.4ml
根据量筒的选择原则是“大而近”,故应选10ml的量筒,即选A.
故答案为:5.4;A.



 在一个体积为2L的密闭容器中,高温下发生下列反应:
在一个体积为2L的密闭容器中,高温下发生下列反应: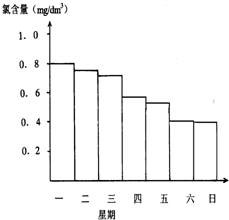 游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,