
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
分析 A.酒精与水互溶,不能作萃取剂;
B.分液时,避免上下层液体混合;
C.蒸馏时,温度计测定馏分的温度;
D.NaOH潮解,具有腐蚀性,应在小烧杯中称量.
解答 解:A.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳萃取碘水中的碘,故A错误;
B.分液时,避免上下层液体混合,下层液体从下口放出,然后上层液体从上口倒出,故B错误;
C.蒸馏时,温度计测定馏分的温度,则应将温度计水银球靠近蒸馏烧瓶支管口处,故C正确;
D.NaOH潮解,具有腐蚀性,应在小烧杯中称量,则将氢氧化钠固体放在托盘天平左盘中的小烧杯中,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验操作和实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
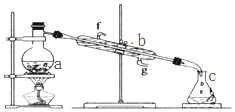 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
?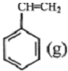 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 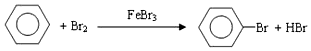 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
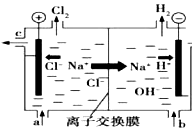 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 | |
| B. | 中和热△H=-57.3 kJ•mol-1,所以1.00 L 1.00 mol•L-1 H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量 | |
| C. | 用等体积的0.50 mol•L-1盐酸、0.55 mol•L-1 NaOH溶液进行中和热测定的实验,会使测得的值偏大 | |
| D. | 在101 kPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com