
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、K+、AlO2-、NO3- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、Cu2+、NO3-、CO32- |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:2 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种金属产生氢气的量相同 | |
| B. | 钠反应生成的氢气的量最多 | |
| C. | 铝反应产生的氢气的量最多 | |
| D. | 钠、镁与酸反应生成的氢气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
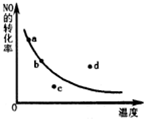 已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中阴离子向正极移动 | |
| B. | 溶液中阴离子物质的量减少 | |
| C. | 负极的电极反应式是:N2H4+4OH--4e-═4H2O+N2↑ | |
| D. | 正极的电极反应式是:O2+4H++4e-═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com