
在体积一定的密闭容器中给定物质A、B、C的量,在一 定 条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
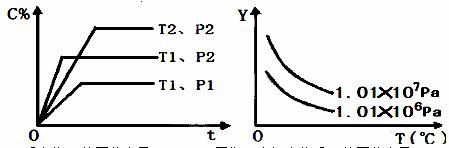
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
科目:高中化学 来源: 题型:
现用0.10 mol·L-1HCl溶液滴定10 mL 0.05 mol·L-1NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10 mL B.5 mLC.小于5 mL D.大于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨工业中,为增加NH3的日产量,实施下列目的的变化过程中与平衡移动无关的是
A.不断将氨分离出来 B.使用催化剂
C.采用500℃左右的高温而不是700℃的高温 D.采用2×107~5×107Pa的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+ O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+ O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A.① B.④ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)  H2O(g) +CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
H2O(g) +CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热),反应达到平衡后,此时将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。
2SO3(正反应放热),反应达到平衡后,此时将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。
(1)求该反应达到平衡时SO2的转化率____ __(用百分数表示)。
(2)判断该反应达到平衡状态的标志是_______。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(3)欲提高SO2的转化率,下列措施可行的是_______。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(4)若保持容积不变,当达到平衡时充入氩气,平衡将 (填“正向”“逆向”或“不移动”)。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“正向”“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质。已知:甲 + 乙 =丁 +辛,甲 + 丙 = 戊 + 辛;常温下0.1 mol/L 丁溶液的pH为13,则下列说法正确的是
A.元素B、C、D的原子半径由大到小的顺序为:r(D) > r(C) > r(B)
B.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合 物中均存在共价键
C.1.0 L 0. 1 mol/L戊溶液中含阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204 × 1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
2011年4月22日是第42个“世界地球日”,“世界地球日”活动的主题同国际地球年中国行动的主题一样——“认识地球,和谐发展”。下列有关活动或行为不符合这一主题的是( )
A.发展循环经济,构建资源节约型社会及开发清洁生产技术
B.采用绿色化学生产工艺,建立环境友好型化工体系
C.大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D.设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com