
| A. | 氧化铝 | B. | 氢氧化铝 | C. | 铝 | D. | 碳酸氢钠 |
分析 Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸铵盐、蛋白质、氨基酸等都能和稀盐酸、NaOH溶液反应,据此分析解答.
解答 解:A.氧化铝属于两性氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,但氧化铝是氧化物,故A错误;
B.氢氧化铝属于两性氢氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,但氢氧化铝是两性氢氧化物,故B错误;
C.Al能和稀盐酸、NaOH溶液反应生成盐和氢气,但Al属于单质,故C错误;
D.碳酸氢钠属于弱酸酸式盐,能和稀盐酸、NaOH溶液反应,且碳酸氢钠属于盐,故D正确;
故选D.
点评 本题考查元素化合物,为高频考点,明确元素化合物性质及物质之间转化是解本题关键,侧重考查学生分析判断能力,注意题干中限制性条件“盐”,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
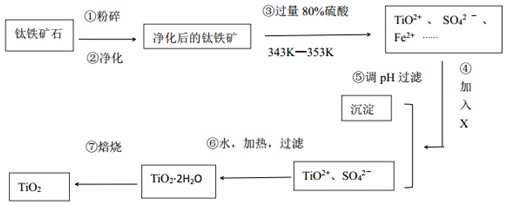
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
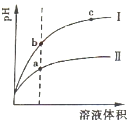 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com