
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
分析 原电池反应Fe+Cu2+═Fe2++Cu中,Fe为负极,负极上Fe失电子发生氧化反应,正极上铜离子得电子发生还原反应,所以Fe作原电池负极,活泼性比Fe弱金属或导电的非金属作正极,电解质溶液为含有铜离子的可溶性盐,据进行解答.
解答 解:A.该反应中Fe失去电子被氧化,则Fe为负极,故A正确;
B.正极为活泼性比Fe弱金属或导电的非金属,可以为石墨,故B正确;
C.电解质溶液为含有铜离子的可溶性盐,可以为CuSO4溶液,故C正确;
D.电子只能在导线中移动,不会在电解质中移动,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH3分子比PH3分子稳定 | |
| B. | 通常情况NH3极易溶于水 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
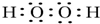 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19 | B. | 30 | C. | 45 | D. | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;含极性共价键的分子的中心原子轨道杂化类型sp;
;含极性共价键的分子的中心原子轨道杂化类型sp;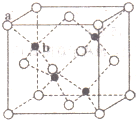
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com