
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
分析 A、根据m=nM=$\frac{N}{{N}_{A}}$M=$\frac{V}{Vm}$M来计算;
B、根据ρ=$\frac{M}{Vm}$=$\frac{m}{V}$来计算或者根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比;
C、根据V=nVm=$\frac{m}{M}$Vm=$\frac{N}{{N}_{A}}$Vm来计算,或者根据阿伏伽德罗定律的推论:同温同压下,体积之比等于物质的量之比来回答;
D、根据公式计算氢原子的物质的量,进而计算氢原子数.
解答 解:A、6.72LCH4的质量是m=$\frac{V}{Vm}$M=$\frac{6.72L}{22.4L/mol}$×16g/mol=4.8g,3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2molNH3的质量是0.2mol×17g/mol=3.4g,所以质量关系是④<①<③<②,故A正确;
B、根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比,所以密度关系为:①<④<③<②,故B正确;
C、3.01×1023个HCl的体积V=$\frac{N}{{N}_{A}}$Vm=0.5mol×22.4L/mol=11.2L,13.6gH2S的体积V=$\frac{m}{M}$Vm=$\frac{13.6g}{34g/mol}$×22.4L/mol=8.96L,0.2molNH3的体积V=0.2mol×22.4L/mol═4.48L,所以体积关系为:④<①<③<②,故C错误;
D、6.72LCH4的物质的量为0.3mol,所以氢原子的物质的量为1.2mol,3.01×1023个HCl的物质的量为0.5mol,所以氢原子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,所以氢原子的物质的量为0.8mol,0.2molNH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是②<④<③<①,故D正确.
故选C.
点评 本题考查学生有关物质的量的相关计算知识,可以根据所学内容来回答,较简单.


科目:高中化学 来源: 题型:解答题
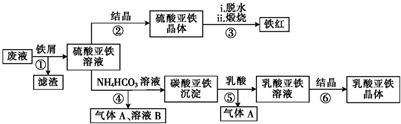
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、纯碱、硫酸钡均为强电解质 | |
| B. | SO2、SiO2、CO均为酸性氧化物 | |
| C. | 稀豆浆、油水、氯化铁溶液均为胶体 | |
| D. | 大理石、CuSO4•5H2O、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中吸收大量的热 | |
| B. | 反应前后原子个数不变 | |
| C. | 该反应属于置换反应 | |
| D. | 参加反应的乙烯和氧气的质量比为9:24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c (OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| B. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-) | |
| C. | 饱和食盐水中:c(Na+)+c (OH-)=c(Cl-)+c(H+) | |
| D. | 50℃时,pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
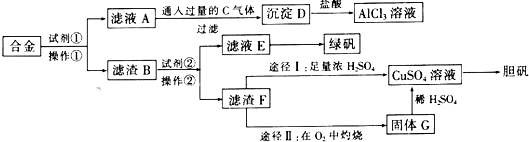
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com