
����Ӫ���ḻ�����С��߲�֮���������ơ�������������˶���ͬʳ���ý�ʯ��ij��ѧ��ȤС��ԡ����˶����Ƿ���ͬʳ�����������̽����
��֪�����˺��зḻ�����������Ρ�̼���εȣ������к��зḻ�ĵ����ʼ����εȡ������ʯ����Ҫ�ɷ֣�����ƣ�CaC2O4������������Ʒ�Ӧ��������̼��Ʒ�Ӧ���ɿ������εȡ�
��̽��һ�������в��ֳɷַ���
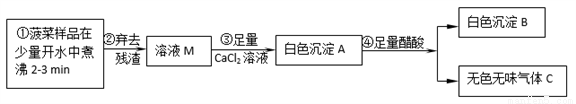
��1��������е�ʵ���Ҳ�������Ҫ�IJ����������ձ�����������________________��
��2����ɫ����B�Ļ�ѧʽ����Ϊ_______________��
��̽������ij����ƾ��壨CaC2O4��xH2O���ȷֽ��о�
����ͼװ�ý�ij����ƾ�����Ʒ���¼��ȣ�ʹ����ȫ�ֽ⣬����������������̽��������װ���и��Լ�����������
��3��ij�о�������SDT Q600�ȷ����ǶԲ���ƾ��壨CaC2O4��xH2O�������ȷֽ⣬��������ݣ����Ƴɹ����������ֽ��¶ȵĹ�ϵ��ͼ��
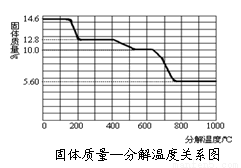
800������ʱ������ɷֵĻ�ѧʽΪ_____________��
��д������������12.8 g��Ϊ10.0 g�����еĵķ�Ӧ����ʽΪ___________��
���Լ������ƾ����x��д��������̣�_______________��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ�ɶ��и�������ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��������泥�H2NCOONH4����һ���ֽ⡢��ˮ��İ�ɫ���壬�����ڻ��ʡ�������ϴ�Ӽ��ȡ�ij��ѧ��ȤС��ģ�ҵԭ���Ʊ���������泥�
��Ӧʽ��2NH3 (g)+CO2 (g)  H2NCOONH4 ��H <0
H2NCOONH4 ��H <0
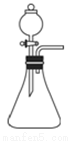
��1�����ʹ����ͼ��ʾ��װ����ȡNH3������ѡ����Լ���_____________��
��2���Ʊ���������淋�װ������ͼ���Ѱ��Ͷ�����̼ͨ�����Ȼ�̼�У����Ͻ����ϣ����ɵİ��������С�������������Ȼ�̼�У���������϶�ʱ��ֹͣ�Ʊ�����ע�����Ȼ�̼��Һ��ʯ����Ϊ���Խ��ʡ���
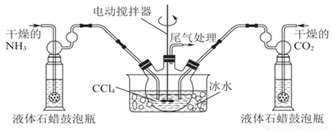
�ٷ������ñ�ˮ��ȴ��ԭ����_______��Һ��ʯ������ƿ��������__________��������Ӧ������������_______________��
�ڴӷ�Ӧ��Ļ�����й��˷������Ʒ��Ϊ�˵õ������Ʒ��Ӧ��ȡ�ķ�����_____ (ѡ����ţ�
a����ѹ���Ⱥ�� b����ѹ���Ⱥ�� c�����40�����º��
��3��β������Ⱦ������________��Һ���մ�����
��4��ȡ�ֱ��ʶ�����̼����淋İ��������Ǯ��Ʒ1.1730g��������ʯ��ˮ��ִ�����ʹ̼Ԫ����ȫת��Ϊ̼��ƣ����ˡ�ϴ�ӡ�����������Ϊ1.500g����Ʒ�а�������淋���������Ϊ__________��[��֪Mr(H2NCOONH4)=78, Mr(NH4HCO3)=79, Mr(CaCO3)=100]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�켪��ʡ�����и�����ѧ�ڵڶ�������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
W��X��Y��Z��Ϊ������Ԫ�أ�ԭ��������������W��ԭ�Ӻ��������������Ǵ�����������2����X-��Y+������ͬ�ĵ��Ӳ�ṹ��Z�������Ӳ��ܷ���ˮ�ⷴӦ������˵������ȷ���ǣ� ��
A. ԭ�Ӱ뾶�� Y��Z��X��W
B. ���⻯����ȶ��ԣ�W��Z��X
C. Z��W��Y�γɵĻ������У��仯ѧ�����Ͳ���ͬ
D. ����������ˮ��������ԣ�W��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������е�ʮ��У�ص���ѧ������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A. �Ȼ�������Һ��ͨ��������Fe2++Cl2=Fe3++2Cl-
B. ������������������ͨ���䰱ˮ�У�SO2+NH3��H2O=HSO3-+NH4+
C. �������������м�������ϡ���Fe(OH)2+2H+=Fe2++2H2O
D. ��������Һ�������Һ��ϣ�SiO32-+2H+=H2SiO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������е�ʮ��У�ص���ѧ������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��KSCN��NaHCO3��BaCl2��C6H5OH��NaOH��������ɫ��Һ�������������Լ���
A. Ũ��ˮ B. ���� C. FeCl3��Һ D. ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶�3��ѧҵˮƽ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л���ѧ����ʽ����Ӧ���;���ȷ���ǣ� ��
A. CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ֬����Ӧ
CH3COOCH2CH3+H2O ֬����Ӧ
B. CH2=CH2+HOCl �� HOCH2��CH2Cl �Ӿ۷�Ӧ
C. 2CH3CH2OH��O2 2CH3CHO��H2O ������Ӧ
2CH3CHO��H2O ������Ӧ
D. CH3Cl+Cl2 CH2Cl2+HCl ȡ����Ӧ
CH2Cl2+HCl ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶�3��ѧҵˮƽ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����Ҵ��������˵����ȷ���ǣ� ��
A. �������Ȼ� B. ����������Ʒ�Ӧ��������
C. �Ҵ���Һ�Լ��ԣ�������Һ������ D. ����ʹ��ɫʯ����Һ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ��ɽ�и����ڶ��ε����о����������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
̼��������FeCO3������þ�����Ҫ�ɷ֣���FeCO3���ȵ�200�濪ʼ�ֽ�ΪFeO��CO2�����ڿ����и�������FeCO3����Fe2O3��
I����֪25�棬101kPaʱ��4Fe(s)+3O2(g)=2Fe2O3(s) ��H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) ��H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) ��H=+148OkJ/mol
��1����д��FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ_______��
�����ɵ�FeO��Fe2O3��һ�������±���ԭΪ��������
��2���ݱ���һ��������Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) ��H>0
�� ԭ������Ϊ26����Ԫ��λ��Ԫ�����ڱ��ĵ�_______���ڡ�
�ڷ�Ӧ��5L���ܱ������н��У�2min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������4.8g����ö�ʱ������H2�����ƽ����Ӧ����Ϊ____________��
�۽�һ������Fe2O3(s)��һ������CH4(g)���ں��º�ѹ�����У���һ�������·�Ӧ���ܱ����÷�Ӧ�ﵽƽ��״̬����___________��
a.CH4��ת���ʵ���CO�IJ��� b����������ƽ����Է�����������
c.v��(CO)��v��(H2)=1:2 d.���������������
��3��FeO����CO���л�ԭ����֪��t��ʱ��FeO(s)+CO(g) Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
��. Fe2O3���������Ʊ�FeCl3��FeCl3��ˮ��Һ�е�ˮ���������
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
��4������ˮ�ⷴӦ��ƽ�ⳣЧK1��K2��K3�ɴ�С��˳����_______��ͨ����������������ˮ�����ۺ����ɾۺ�������ӷ���ʽΪ��xFe3++yH2O===Fex(OH)y(3x-y)++yH+
��ʹƽ�������ƶ��ɲ��õķ�����__________������ĸ��
a����ˮϡ�� b����������NaCl���� c������ d����������Na2CO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�Ƹ��и���3��������������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ɴ��Ľṹ��ʽ����ͼ������˵����ȷ����
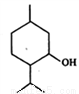
A. ���ɴ����ڷ������ĺ���������
B. ���ɴ�����ʽΪC10H20O�����ǻ�������ͬϵ��
C. ���ɴ����ϵ�һ��ȡ����ֻ������
D. ��һ�������£����ɴ�������������ˮ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com