
【题目】贝诺酯临床主要用于治疗类风湿性关节炎、感冒发烧等。合成路线如下:
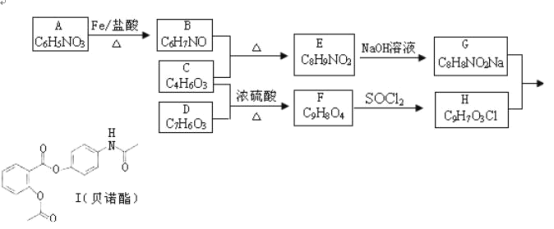
(1)贝诺酯的分子式______。
(2)A→B的反应类型是______;G+H→I的反应类型是______。
(3)写出化合物C、G的结构简式:C______,G______。
(4)写出满足下列条件的F同分异构体的结构简式(任写3种)______。
a.不能与FeCl3溶液发生显色反应;
b.能发生银镜反应和水解反应;
c.能与金属钠反应放出H2;
d.苯环上的一氯取代产物只有两种结构
(5)根据题给信息,设计从A和乙酸出发合成![]() 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
【答案】C17H15NO5 还原反应 取代反应 CH3COOCOCH3 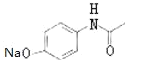
![]() 、
、![]() 、
、 、
、![]() 、
、 (任写三种)
(任写三种) 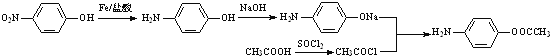
【解析】
根据贝诺酯的结构简式和G、H的分子式可知,G为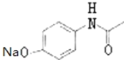 ,H为
,H为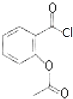 ,再根据题各步转化的条件及有关物质的分子式可推知,E为
,再根据题各步转化的条件及有关物质的分子式可推知,E为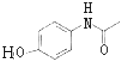 ,B为
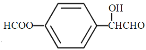
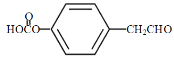
,B为![]() ,C为CH3COOCOCH3,A为
,C为CH3COOCOCH3,A为![]() ,F为
,F为 ,D为
,D为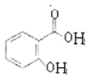 ,A发生还原反应得B,B与C发生取代反应生成E,E与氢氧化钠反应生成G,C与D发生取代反应生成F,F发生取代反应生成H,G和H发生取代反应生成I,据此分析解答。
,A发生还原反应得B,B与C发生取代反应生成E,E与氢氧化钠反应生成G,C与D发生取代反应生成F,F发生取代反应生成H,G和H发生取代反应生成I,据此分析解答。
(1)根据结构简式知,贝诺酯的分子式C17H15NO5,故答案为:C17H15NO5;
(2)A→B的反应类型是还原反应,G+H→Ⅰ的反应类型是取代反应,故答案为:还原反应;取代反应;
(3)根据上面的分析可知,C为CH3COOCOCH3,G为 ,故答案为:CH3COOCOCH3;
,故答案为:CH3COOCOCH3;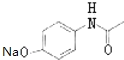 ;
;
(4)a. 不能与FeC13溶液发生显色反应,说明没有酚羟基,b. 能发生银镜反应和水解反应,说明有甲酸某酯的结构或酯基和醛基同时存在,c. 能与金属钠反应放出H2,说明有羟基或羧基,d. 苯环上的一氯取代产物只有两种结构,一般为两个取代基处于对位,则满足条件的F的同分异构体的结构简式为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() (其中的三种);
(其中的三种);
(5)A为![]() ,从A和乙酸出发合成
,从A和乙酸出发合成![]() ,可以先将对硝基苯酚还原成对氨基苯酚,在碱性条件下变成对氨基苯酚钠,将醋酸与SOCl2反应生成CH3COCl,CH3COCl与对氨基苯酚钠发生反应即可得产品,合成线路为
,可以先将对硝基苯酚还原成对氨基苯酚,在碱性条件下变成对氨基苯酚钠,将醋酸与SOCl2反应生成CH3COCl,CH3COCl与对氨基苯酚钠发生反应即可得产品,合成线路为 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
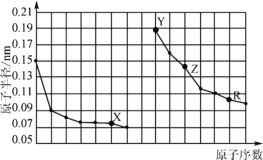
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是( )
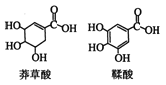
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1950g发烟硫酸(用a SO3H2O 表示),SO3和H2SO4的质量分数分别为0.2和0.8,加b g水稀释成某浓度的硫酸(用H2SO4![]() H2O 表示),则以下正确的是(允许最后一位数字不同)( )
H2O 表示),则以下正确的是(允许最后一位数字不同)( )
A.a=1.38B.a=1.31C.b=174D.b=129
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的电池中,电解质溶液为酸性,则负极反应式为______________,正极反应式为__________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH= -726.5kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
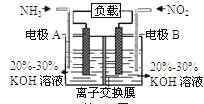
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20→NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
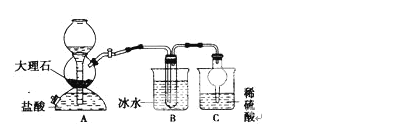
(1)A装置中所发生反应的离子方程式为____ C装置的作用为___
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
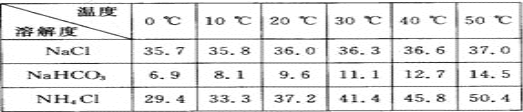
参照表中数据,请分析B装置中使用冰水的目的是__________________________
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在_______装置之间(填写字母)连接一个盛有________的洗气装置,其作用_______________。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com