
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
科目:高中化学 来源: 题型:选择题
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
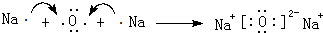 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com