
 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子. .
.分析 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体,则A为碳元素;元素C的原子最外层电子数是其内层的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故C为O元素;B的原子序数介于氮、氧之间,故B为N元素;基态D原子的价电子排布为(n+1)dn(n+2)sn,可知n=2,故D为Ti;基态E2+的3d轨道中有5个电子,E原子外围电子排布式为3d54s2,则E为Mn.
解答 解:周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体,则A为碳元素;元素C的原子最外层电子数是其内层的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故C为O元素;B的原子序数介于氮、氧之间,故B为N元素;基态D原子的价电子排布为(n+1)dn(n+2)sn,可知n=2,故D为Ti;基态E2+的3d轨道中有5个电子,E原子外围电子排布式为3d54s2,则E为Mn.
(1)E为Mn,E基态原子的核外电子排布式是1s22s22p63s23p63d54s2,N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的,NO3-中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,故其空间构型是平面三角形,
故答案为:1s22s22p63s23p63d54s2;N;平面三角形;
(2)A和B的最简单氢化物分别为CH4、NH3,NH3分子之间形成氢键,沸点高于甲烷的,氮元素的某种氢化物中含有3个σ键和1个π键的分子的电子式是: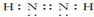 ,
,
故答案为:NH3;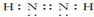 ;
;
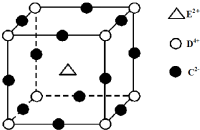
(3)由C、D、E三种元素组成的某化合物
由晶胞结构可知,D4+的配位数是6,为棱中心的6个C2-,晶胞中Mn原子数目为1,Ti原子数目8×$\frac{1}{8}$=1,O原子数目为12×$\frac{1}{4}$=3,该化合物的化学式为MnO•TiO2,
故答案为:MnO•TiO2;
(4)常温下MnO2与硫酸亚铁在酸性条件下反应可得Mn2+,亚铁离子被氧化生成Fe3+,则该反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型、氢键、晶胞计算与计算、氧化还原反应等,注意同周期主族元素中第一电离能异常情况,掌握均摊法进行晶胞的有关计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
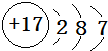
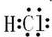 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从石油中获得乙烯,已成为目前工业上生产乙烯的主要途径 | |
| B. | 催化剂一般在金属与非金属的分界处寻找 | |
| C. | 硅是一种良好的导热、导电材料 | |
| D. | 氢的同位素${\;}_{1}^{1}$H可用于制造氢弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2═2 Li2O,则钠与氧气反应:4Na+O2═2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
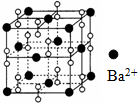
| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com