
下列说法不正确的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.用热的纯碱溶液去油污效果更好
C.制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法
D.室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:实验题
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
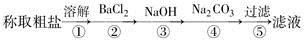

(1)判断BaCl2已过量的方法是___________________________。
(2)第④步中,相关的化学方程式是__________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( )
B.天平的砝码已锈蚀( )
C.定容时俯视刻度线( )
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
热化学方程式C(s)+H2O(g)==CO(g)+H2(g) ΔH=+131.3 kJ/mol表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0,下列叙述正确的是
H++ OH- ΔH > 0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:实验题
滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:
Ⅰ、某学生用0.1 mol·L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_________AF。
(2)上述B步骤操作的目的是______________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的__________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__________(①=10mL,②=15mL,③<10mL,④>15mL)。
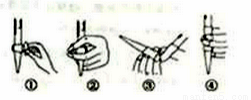
(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____________。
Ⅱ、氧化还原滴定法实际生产中运用较为广泛的方法。制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2·xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2。
可用氧化还原滴定法测定TiO2的质量分数。在一定条件下,将粉体溶解并将溶液中的Ti2-氧化为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。【注:NH4Fe(SO4)2是一种复盐,含有两种阳离子】。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量稀H2SO4的原因是____________________,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需用到图中的______________(填序号)
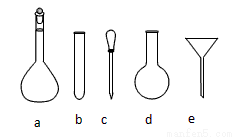
检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
(3)滴定终点的现象是:当滴入最后一滴NH4Fe(SO4)2标准溶液时_______________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)粉体试样wg,消耗v ml c mol·L-1 NH4Fe(SO4)2标准溶液。则TiO2质量分数表达式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
现有两正盐的稀溶液,分别是a mol/L NaX溶液和b mol/L NaY溶液。下列说法不正确的是
A.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY)
B.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)=c(HY)
C.若a=b,且pH(NaX)>pH(NaY),则浓度相同时,酸性HX<HY
D.若a=b,并测得 a=c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
化学与生活、生产密切相关。下列生活、生产中使用的化学品的溶液能够使pH试纸变蓝,且原因是水解引起的是
A.烧碱 B.食用醋 C.氯化铵 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com