
【题目】某研究性学习小组设计了一组实验,验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象.①甲同学设计实验的目的是;
②反应最剧烈的烧杯是(填字母);
③写出b烧杯里发生反应的离子方程式 .
(2)乙同学设计实验验证:元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如下图装置验证C、N、Si三种元素的非金属性强弱.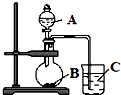
①写出所选用物质的化学式:A; B;C;
②写出圆底烧瓶中发生反应的离子方程式;
③写出烧杯中发生反应的离子方程式;
④碳、氮、硅三种元素的非金属性由强到弱顺序为;
(3)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该置中应盛放(填试剂).
【答案】
(1)验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);C;2Na+2H2O=2Na++2OH﹣+H2↑
(2)HNO3;CaCO3;Na2SiO3;2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;CO2+H2O+SiO ![]() =H2SiO3↓+CO
=H2SiO3↓+CO ![]() 或2CO2+2H2O+SiO
或2CO2+2H2O+SiO ![]() =H2SiO3↓+2HCO
=H2SiO3↓+2HCO ![]() ;氮>碳>硅
;氮>碳>硅
(3)饱和NaHCO3
【解析】解:(1)①由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱,所以答案是:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C,所以答案是:C;③钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2 Na+2H2O=2Na++2OH﹣+H2↑,所以答案是:2 Na+2H2O=2Na++2OH﹣+H2↑;(2)①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,所以答案是:HNO3;CaCO3;Na2SiO3(或K2SiO3);②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,离子反应方程式为:2H++CaCO3=Ca2++H2O+CO2↑,所以答案是:2H++CaCO3=Ca2++H2O+CO2↑;③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3 , 离子反应方程式为:CO2+H2O+SiO ![]() =H2SiO3↓+CO32﹣或2CO2+2H2O+SiO
=H2SiO3↓+CO32﹣或2CO2+2H2O+SiO ![]() =H2SiO3↓+2HCO
=H2SiO3↓+2HCO ![]() ;所以答案是:CO2+H2O+SiO
;所以答案是:CO2+H2O+SiO ![]() =H2SiO3↓+CO32﹣或2CO2+2H2O+SiO
=H2SiO3↓+CO32﹣或2CO2+2H2O+SiO ![]() =H2SiO3↓+2HCO
=H2SiO3↓+2HCO ![]() ;④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,所以答案是:氮>碳>硅;(3)因硝酸易挥发,则生成的二氧化碳气体中混有硝酸蒸气,则应用饱和碳酸氢钠除去硝酸,所以答案是:饱和NaHCO3 .
;④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,所以答案是:氮>碳>硅;(3)因硝酸易挥发,则生成的二氧化碳气体中混有硝酸蒸气,则应用饱和碳酸氢钠除去硝酸,所以答案是:饱和NaHCO3 .


科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是热反应,且a+bp(填“>”“<”或“=”).
(2)减压时,A的质量分数(填“增大”“减小”或“不变”,下同),正反应速率 .
(3)若加入B(体积不变),则A的转化率 , B的转化率 .
(4)若升高温度,则平衡时,B、C的浓度之比 ![]() 将
将
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色 , 而维持容器内气体的压强不变,充入氖气时,混合物的颜色 . (填“变浅”“变深”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下: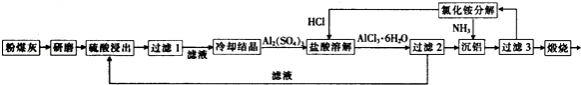
(1)粉煤灰研磨的目的是 .
(2)第1次过滤时滤渣的主要成分有(填化学式,下同)和 , 第3次过滤时滤渣的成分是
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为h;铝的浸取率与 ![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 ![]() 相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例).
相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例). 
(4)流程中循环使用的物质有和 . (填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C136H20,该过程能够发生的原因是
(6)用粉煤灰制取含铝化合物的主要意义是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下同分异构体数目正确的是( )
A.C4H10属于烷烃的同分异构体有3种
B.结构为 ![]() 的一溴代物有5种
的一溴代物有5种
C.分子组成是C4H8O属于醛类的同分异构体有3种
D.分子组成是C5H10O2属于羧酸的同分异构体有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果.用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系: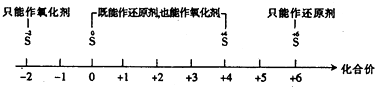
B.分散系的分类: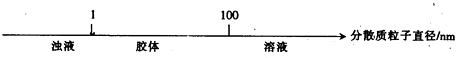
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D.CO2与NaOH溶液反应后的产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NH4NO3
A. ②③B. ④⑤C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH═CHR2 , 被氧化为 ![]() 和
和 ![]() ;
;  被氧化为
被氧化为  和
和  ,由此推断分子式为C4H8的烯烃的氧化产物有( )
,由此推断分子式为C4H8的烯烃的氧化产物有( )
A.2种
B.3种
C.4种
D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是()
A. 打开汽水瓶有气泡从溶液中冒出
B. 实验室用排饱和食盐水法收集氯气
C. 合成氨工厂采用增大压强以提高原料的转化率
D. 2NO2(g)![]() N2O4(g)的平衡体系中, 加压缩小体积后颜色加深
N2O4(g)的平衡体系中, 加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定﹣﹣已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为 .
(3)若出现下列情况,测定结果偏高的是 .
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
(4)Ⅱ.氧化还原滴定﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是
(5)Ⅲ.沉淀滴定﹣﹣滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母).
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10﹣10 | 5.35×10﹣13 | 1.21×10﹣16 | 1.12×10﹣12 | 1.0×10﹣12 |
A.NaCl
B.NaBr
C.NaCN
D.Na2CrO4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com