
| A、向水中通入氯气:Cl2+H2O?H++Cl-+HClO | ||||
B、向明矾溶液中加过量氨水:Al3++4NH3?H2O=AlO
| ||||
| C、硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至溶液恰好呈中性:Ba2++OH-+SO42-+H+=BaSO4↓+H2O | ||||
D、溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br+OH-
|


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(S/mol?L-1)如图所示.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(S/mol?L-1)如图所示.| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,2L pH=11的Na2CO3的水溶液中水电离出来的H+数为2×10-11 |
| B、常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA |
| C、78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA |
| D、标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
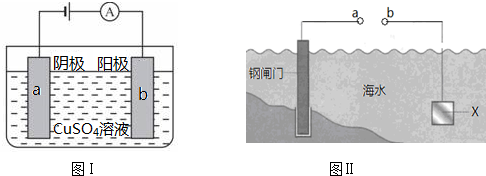 ( )
( )| A、图Ⅰ中a为纯铜 |
| B、图Ⅰ中SO42-向b极移动 |
| C、图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D、图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液不可能由pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合而成 |
| B、该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C、在NaOH溶液中加入一定量的CH3COOH溶液,只有当溶液中离子浓度满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,才符合题意 |
| D、加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| B、该溶液由0.1 mol?L-1的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 |
| C、在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH不会发生显著变化 |
| D、在上述溶液中加入适量NaOH溶液,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO
| ||
B、NH
| ||
| C、Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| D、F-+H2O═HF+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、如果5.6 L N2中含有n个氮气分子,则阿伏加德罗常数一定为4n |
| B、标准状况下,22.4 L空气中含有NA个单质分子 |
| C、60 g SiO2晶体中含有Si-O键的数目为4NA |
| D、1 mol Al3+完全水解生成Al(OH)3胶体粒子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com