

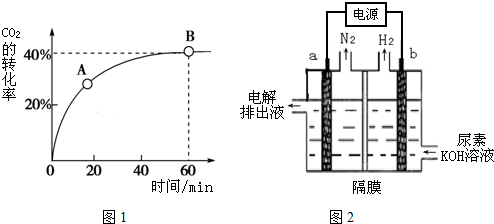
���� ��1����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ���ɷ���ʽ��֪���÷�Ӧ����Ӧ����������ʵ�����С�ķ�Ӧ��������ӦΪ�ؼ����̣�
��2����ͼ2��֪���״���Ũ�ȱ仯��Ϊ0.75mol/L������v=$\frac{��c}{��t}$����v��CH3OH��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��H2��������ͼ��������Ӧ���Ķ�����̼��Ũ�ȣ�Ȼ������������̼��ת���ʣ��ȼ���Ũ���̡���ѧƽ�ⳣ��������Ũ�����뻯ѧƽ�ⳣ����Դ�Сȷ����Ӧ����
��3�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��4����Ӧ����������ƽ��������Ӧ�����ƶ����ı����������������Ӧ��Ũ�ȡ�����ѹǿ��
��� �⣺��1����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ������H��0���ɷ���ʽ��֪���÷�Ӧ����Ӧ����������ʵ�����С�ķ�Ӧ��������ӦΪ�ؼ����̣�����S��0��ѡC��
��2����ͼ2��֪��10min��ƽ��ʱ�״���Ũ�ȱ仯��Ϊ0.75mol/L������v��CH3OH��=$\frac{0.75mol/L}{10min}$=0.075mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��H2��=3v��CH3OH��=3��0.075mol/��L•min��=0.225mol/��L•min����
ƽ��ʱ������̼��Ũ��Ϊ0.25mol/L����Ӧ��ʼʱ������̼��Ũ��Ϊ1mol/L���������̼��ת����Ϊ��$\frac{1mol/L-0.25mol/L}{1mol/L}$��100%=75%��
ƽ��ʱc��CH3OH��=c��H2O��=0.75mol/L��c��CO2��=0.25mol/L����Ӧ���Ķ�����̼Ũ��Ϊ0.75mol/L����Ӧ��������Ũ��Ϊ0.75mol/L��3=2.25mol/L����ﵽƽ��ʱ����Ũ��Ϊ��c��H2��=3mol/L-2.25mol/L=0.75mol/L�����Ը��¶��¸÷�Ӧ��ƽ�ⳣ��K=$\frac{0.75��0.75}{0.25��0.7{5}^{3}}$=$\frac{16}{3}$��
ijһʱ�����������к���1mol H2��1.2mol CO2��0.8mol CH3OH��1.5mol H2O���⼸�����ʵ����ʵ���Ũ�ȷֱ���1mol/L��1.2mol/L��0.8mol/L��1.5mol/L��Ũ����=$\frac{0.8��1.5}{{1}^{3}��1.2}$=1��$\frac{16}{3}$��ƽ�������ƶ���
�ʴ�Ϊ��0.225 mol•L-1•min-1��75%��������Ӧ��������У�QC�T1��K=5.33��
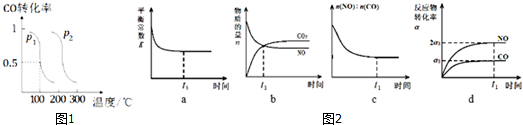
��3��a��n��CO2����n��H2����n��CH3OH����n��H2O��=1��3��1��1ʱ���÷�Ӧ��һ���ﵽƽ��״̬��
�뷴Ӧ��ʼŨ�ȼ�ת�����йأ��ʴ���
b����Ӧǰ��������ѹǿ��С����������ѹǿ���ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
c�����۷�Ӧ�Ƿ�ﵽƽ��״̬�������ڵ��ܶ�ʼ�ձ��ֲ��䣬���ܾݴ��ж�ƽ��״̬���ʴ���
d��H2������������CH3OH����������֮��Ϊ3��1ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
��ѡbd��
��4��a����ʱ�����CH3OH���壬ƽ�������ƶ�������Ӧ���ʼ�С���ʴ���
b���ʵ������¶ȣ�ƽ�������ƶ����ʴ���
c�������������ݻ����䣬�ٳ���1mol CO2��3mol H2����Ӧ��Ũ������ƽ�������ƶ�����Ӧ���ʼӿ죬����ȷ��
d��ѡ���Ч�Ĵ�����ƽ�ⲻ�ƶ����ʴ���
��ѡc��
���� ���⿼���˻�ѧƽ��ʱ�ļ��㣬��Ŀ�Ѷ��еȣ���ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ���ע�����ջ�ѧƽ�ⳣ���ĸ������ʽ������������ѧ���ķ�����������ѧ����������


 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡ H2SO4�����۷�Ӧ��2Fe+6H+=2Fe3++3H2�� | |
| B�� | ����������Һ��ϡH2SO4 ��Ӧ��H++SO42-+Ba2++OH-=H2O+BaSO4�� | |
| C�� | �����������Һ��Ӧ��CO32-+2H+=H2O+CO2�� | |
| D�� | ����ͭ����ϡ���CuO+2H+=Cu2++H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al2��SO4��3�T2Al3++3SO42- | B�� | NaHCO3�TNa++H++CO32- | ||
| C�� | NaHSO4�TNa++HSO4- | D�� | KClO3�TK++Cl-+3O2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO2��g����3mol H2��g�� | 1mol CH3OH��g����1mol H2O��g�� |
| ƽ��ʱc��CH3OH�� | c1 | c2 |
| ƽ��ʱ�����仯 | �ų�29.4kJ | ���� a kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10�� | 35.8 | 8.15 | 33.0 |
| 45�� | 37.0 | 14.0 | 50.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.0��10-6mol/L | B�� | 3.2��10-6mol/L | C�� | 2.0��10-9mol/L | D�� | 3.2��10-9mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com