
| A. | 在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等 | |
| B. | 等物质的量的N2和CO在标准状况下的体积均为22.4L | |
| C. | 同温同压下,等体积的物质所含分子数目一定相等 | |
| D. | 1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目相同 |
分析 A.根据N=nNA计算分析;
B.标准状况下,Vm=22.4L/mol;
C.同温同压下,等体积的气体所含有分子数相同;
D.盐酸中没有HCl分子,但是含有水分子.
解答 解:A.在任何条件下,等物质的量的乙烯(C2H4)和CO,由N=nNA可知所含的分子数目相等,故A正确;
B.标准状况下,Vm=22.4L/mol,由于气体的物质的量不知道,所以无法计算气体的体积,故B错误;
C.同温同压下,等体积的气体所含有分子数相同,不是气体无法计算分子数,故C错误;
D.盐酸中没有HCl分子,但是含有水分子,则1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目不相同,故D错误.
故选A.
点评 本题考查了阿伏伽德罗定律及其推论、物质的量的计算等,题目难度不大,注意把握阿伏伽德罗定律及其推论的内容.


科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
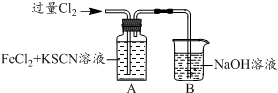 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
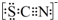 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH 溶液与FeCl3 溶液加足量稀硝酸 | |
| B. | Ba(OH)2 溶液与KNO3溶液加足量H2SO4 | |
| C. | CuSO4溶液与NaOH 溶液加足量稀盐酸 | |
| D. | BaCl2 溶液与Na2CO3 溶液加足量稀醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Na2O | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫 | |
| B. | 镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀 | |
| C. | 加热后的纯碱水洗油污比冷碱水效果好 | |
| D. | FeCl3滴入沸水中,煮沸片刻得到红褐色胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.005mol | B. | 0.01mol | C. | 0.025mol | D. | 0.03mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com