
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH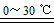 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生氧化反应 D.Cl2是还原剂
科目:高中化学 来源: 题型:多选题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Mg2+、Ca2+、HCO3-、Cl- | ||
| C. | Ba2+、Al3+、Cl-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:简答题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。据此回答下列问题:
(1)L的常见原子组成符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用具体元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B的结构式为 。Z和L也能组成原子数目比2∶4的分子C, 已知1 mol 液态C和液态B燃烧时生成无毒无害物质,并释放524.5 kJ的热量,试写出该反应的热化学方程式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
A.+99.7 kJ·mol-1 | B.+29.7 kJ·mol-1 | C.-20.6 kJ·mol-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出阳极生成R的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列变化的实质相似的是( )
① 浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
② 二氧化硫和氯气均能使品红溶液褪色
③ 二氧化硫能使高锰酸钾溶液、溴水褪色
④ 氨气和碘化氢气体均不能用浓硫酸干燥
⑤ 常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥ 浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A.只有②③④ B.只有③⑤ C.只有③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:简答题
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
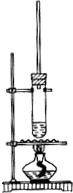 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )| A. | 为了控制温度可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯可用饱和碳酸钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
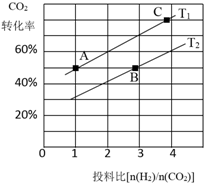 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.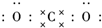 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
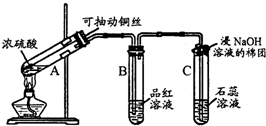
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
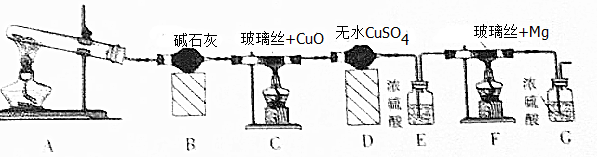
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com