

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙收集氯气并防止污染空气 | |
| D. | 用装置丁分离二氧化锰和氯化锰溶液 |
分析 A.浓盐酸与二氧化锰加热可生成氯气;
B.氯气、HCl均与碳酸氢钠溶液反应;
C.氯气的密度比空气大,且与碱石灰反应;
D.二氧化锰不溶于水,氯化锰溶于水.
解答 解:A.浓盐酸与二氧化锰加热可生成氯气,图中固液反应且加热装置可制备氯气,故A正确;
B.氯气、HCl均与碳酸氢钠溶液反应,则不能除杂,应选饱和食盐水除杂,故B错误;
C.氯气的密度比空气大,且与碱石灰反应,则图中向上排空气法收集及碱石灰吸收尾气合理,故C正确;
D.二氧化锰不溶于水,氯化锰溶于水,则图中过滤装置可分离,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯、气体的收集及尾气处理等,把握物质的性质、反应原理为解答的关键,侧重元素化合物知识及实验技能的综合应用能力的考查,注意实验的评价性分析和实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
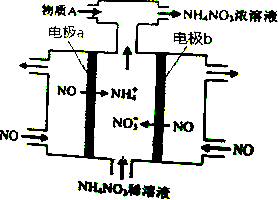
| A. | b极的电极反应为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O | |
| B. | 溶液中的H+由电极b处向电极a处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>AsH3>PH3 | B. | 熔点:Cs>Li>Na | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
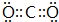 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
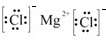 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯(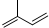 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 甲醇在铜催化和加热条件下生成的产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com