
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于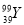 的说法正确的是( )
的说法正确的是( )
A. Y在周期表中的位置是第4周期IIIB族 B. 属于非金属元素
C. 核素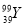 的质子数与中子数之差为50 D.
的质子数与中子数之差为50 D. 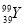 和
和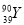 是两种不同的核素
是两种不同的核素
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C( )
A. 具有氧化性 B. 具有还原性
C. 既有氧化性,又有还原性 D. 具有酸性
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A. 元素Z、W的简单离子的电子层结构不同
B. 元素Y的简单气态氢化物的热稳定性比Z的强
C. 仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:填空题
己知H元素有多种同位素。
(1)有H、D (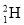 )、T(
)、T(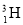 )三种原子,各自可形成双原子分子H2、D2、T2。
)三种原子,各自可形成双原子分子H2、D2、T2。
①标准状况下,它们的密度之比为___________。
②相同物质的量的三种单质中,质子数之比为______________。
③同温同压下,1L各单质气体中所含电子数之比为__________。
(2)36gH2O与80gD2O的物质的量之比是__________,它们分別与Na反应时,所放出气体体积之比(同条件)是__________,质量之比是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | G | I | J | K | |
化合价 | -1 | -2 | +4 -4 | +7 -1 | +5 -3 | +3 | +2 | +1 | |
原子半径/ nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 | |
A. A的单质是一种常见的还原剂 B. E的含氧酸酸性比D的含氧酸酸性强
C. A、I、J的商子半径由大到小顺序是A>J>I D. A的气态氢化物是强酸
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
化学离不开生活,生活也离不开化学。下列叙述中科学的是
A. 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质”
B. 医用酒精是利用了乙醇的氧化性来杀菌消毒的
C. 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂
D. 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分.
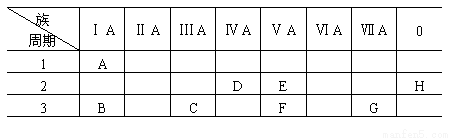
(1)写出元素符号: A________、F________。
(2)根据A~H元素在周期表中的位置,选适当的化学式或方程式填入空白处。
①单质中氧化性最强的是________,还原性最强的是________。
②最高价氧化物对应水化物碱性最强的是________,气态氢化物水溶液酸性最强的是_______。
③写出C的单质与B的最高价氧化物水化物溶液反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:填空题
重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
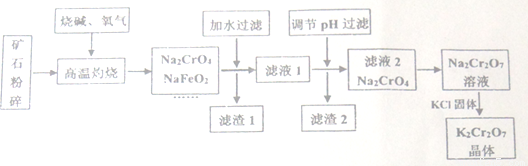
已知:①NaFeO2遇水强烈水解②2CrO42-(黄色) + 2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
请回答下列问题:
(1)将矿石粉碎的目的是________;高温灼烧时Cr2O3发生反应的化学方程式为__________。
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式________。滤渣2的主要成分是A1(OH)3和______________。
(3)用简要的文字说明Na2Cr2O7溶液中加入KC1固体,降温析出K2Cr2O7的原因_______。
(4) 25°C时,对反应2CrO42-(黄色)+2H+ Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
时间/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol·L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
(Cr2O72-)/ (mol·L-1) | 0 | 9.2×l0-2 | 9.4×10-2 | 9.5×10-2 |
反应达到平衡时,溶液的pH=l,该反应平衡常数K为______。
②下列有关说法正确的_____________。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03 s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2 : 1时该反应己达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com