
【题目】焦炉气的主要成分是( )
A. 乙烯和丙烯 B. CO、CO2和N2
C. CO、H2、CH4和C2H4 D. CH4和N2
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是

A. 常压下五种元素的单质中Z单质的沸点最高
B. Y元素的非金属性比W元素的非金属性强
C. W的氢化物比X的氢化物稳定
D. Y、Z的阴离子电子层结构都与R原子的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金。Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Cu基态原子核外电子排布式为________________。
(2)1 mol Ni(CO)4中含有σ键的数目为_______________。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是___________,与SO42-互为等电子体的分子为_______________。(填化学式)
(4) NH3的沸点_______________。(选填“高于”或“低于”)PH3,原因是_______________。
(5)某白铜合金晶胞结构如右图所示.晶胞中铜原子与镍原子的个数比为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)某元素的气态氢化物的化学式XH4,则其最高价氧化物对应的水化物的化学式为_________。
(2)氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则氧元素的相对原子质量为_________________。
(3)物质的量相同的H2O和D2O与足量钠反应,放出的气体的质量之比为 ____________。
(4)X2﹣含中子N个,X的质量数为A,则1g X的氢化物中含质子的物质的量是 ______mol。
(5)铷和另一种碱金属形成的合金4.6g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学综合应用
(Ⅰ) 选择合适的图象:
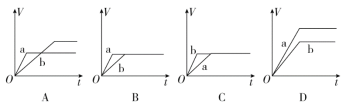
(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是_____________。
(2)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图象是 。
(Ⅱ)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式是_________________________。
(2)乙装置中铁极的电极反应式为_______________________。
(3)检验石墨(C)极反应产物的方法是____________ _________。
(4)若在标准状况下,有2.24 L氧气参加反应,丙装置中阴极析出铜的质量为________g。

(Ⅲ)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的高效水处理剂,其电解制法如图所示。电解过程中,两极均有气体产生,Y极区域溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍澄清。查阅资料得知,高铁酸根离子(FeO![]() )在溶液中呈紫红色。
)在溶液中呈紫红色。
(1)电解过程中,X极区溶液的pH___________(填“增大”“减小”或“不变”)。
(2)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===FeO![]() +4H2O和_____ _____。
+4H2O和_____ _____。
(3)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少__________g。
(4)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:

已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]()
![]() 、
、![]() 、
、![]() 、
、![]() 具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是
具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是
A.原子序数:b > a > c >d
B.原子半径:A > B > C > D
C.金属性:B > A,非金属性:D > C
D.离子半径:D > C > B > A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Mg2+,则下述离子组中能与上述离子共存的是( )
A.CO32-、Cl- B.NO3-、Cl-
C.NO3-、SO42- D.OH-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com