
| A. | 1mol MgCl2中含有的离子数为3NA | |
| B. | 标况下3.36LCCl4中所含碳原子数约为0.15×6.02×1023 | |
| C. | 标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA | |
| D. | 标准状况下,1molCl2在反应中一定得到2NA电子 |
分析 A、氯化镁由1个镁离子和2个氯离子构成;
B、标况下四氯化碳为液态;
C、氦气为单原子分子,氯气为双原子分子;
D、氯气反应后的价态不明确.
解答 解:A、氯化镁由1个镁离子和2个氯离子构成,故1mol氯化镁中含3NA个离子,故A正确;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和碳原子个数,故错误;
C、氦气为单原子分子,氯气为双原子分子,故标况下22.4L氦气即1mol氦气中含NA个原子,而氯气中含2NA个,故C错误;
D、氯气反应后的价态不明确,故1mol氯气反应后转移的电子数无法确定,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl和AgNO3 | B. | Na2CO3和稀盐酸 | C. | Al2(SO4)3和NaOH | D. | 盐酸和Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题: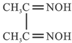 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe、FeO和Fe2O3的混合物中加入过量的盐酸 | |
| B. | 等物质的量的 NaHCO3溶液与 Na2O2固体 | |
| C. | 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液 | |
| D. | 在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
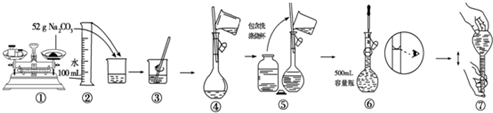
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
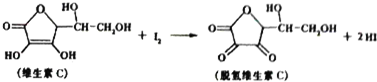
| A. | 脱氢维生素C的分子式为C6H7O6 | B. | 上述反应为氧化反应 | ||
| C. | 滴定时反应剧烈振荡锥形瓶 | D. | 滴定时不可以用淀粉溶液作指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com