
| A、Ba(OH)2 和Na2CO3溶液 |
| B、Na和H2O |
| C、KOH和NaCl溶液 |
| D、Na2O2和H2O |


科目:高中化学 来源: 题型:
| A、200ml 3mol/L MgCl2溶液 |
| B、1000ml 4mol/L NaCl溶液 |
| C、300ml 5mol/L KCL溶液 |
| D、1000ml 1mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将22.4 L氯化氢气体溶于水配成1 L溶液 |
| B、将40 g NaOH溶于1L水中配成溶液 |
| C、从1 L 1 mol/L的NaOH溶液中取出50 mL,则取出的溶液中溶质的物质的量浓度 |
| D、将1 L 10 mol/L的浓盐酸与9 L水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
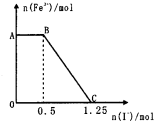 已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
| D、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
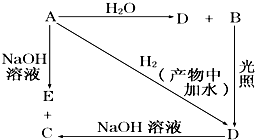 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com