
| A. | 铝是还原剂,其氧化产物是H2 | B. | NaOH是氧化剂,其还原产物是H2 | ||
| C. | 铝是还原剂,H2O和NaOH都是氧化剂 | D. | H2O是氧化剂,Al被氧化 |
分析 在氧化还原反应中,得电子化合价降低的反应物是氧化剂,对应产物是还原产物,失电子化合价升高的反应物是还原剂,对应产物是氧化产物.
解答 解:A.铝和氢氧化钠溶液反应方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,实质是金属铝和水先反应生成氢氧化铝和氢气,再是氢氧化铝和氢氧化钠之间反应生成偏铝酸钠,铝元素的化合价从0价升高到+3价,金属铝是还原剂,对应产物NaAlO2是氧化产物,故A错误;
B.氢元素的化合价降低,H2O是氧化剂,氢气是还原产物,故B错误;
C.铝是还原剂,H2O是氧化剂,故C错误;
D.H2O是氧化剂,铝元素的化合价从0价升高到+3价,Al被氧化,故D正确;
故选D.
点评 本题考查了铝和氢氧化钠溶液的反应,根据元素化合价变化来分析解答,注意铝和氢氧化钠反应实质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、Na2CO3•10H2O、Ca(OH)2 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、生石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中滴入CuSO4溶液 OH-+Cu2+=Cu(OH)2↓ | |
| B. | 乙醛发生银镜反应CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4+2Ag↓+3NH3+H2O | |
| C. | 醋酸与碳酸钠溶液反应 CO32-+2H+=H2O+CO2↑ | |
| D. | 溴乙烷中滴入AgNO3溶液 Ag++Br-=AgBr↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
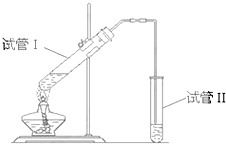 如图所示装置,该装置用于制备少量乙酸乙酯,请回答:
如图所示装置,该装置用于制备少量乙酸乙酯,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
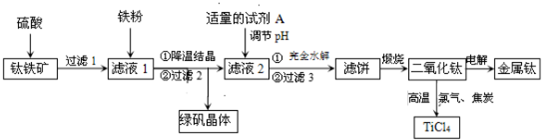
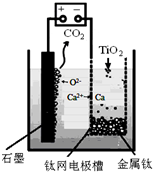
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com