
【题目】某同学分别用下列装置a和b制备溴苯,下列说法错误的是

A.两烧瓶中均出现红棕色气体,说明液溴沸点低
B.a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应
C.b装置试管中CCl4吸收Br2,液体变红棕色
D.b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
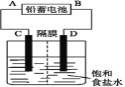
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42--2e- =PbSO4
正极PbO2+4H++SO42-+2e- =PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_________________________。
(2)若在电解池C极一侧滴酚酞溶液,电解一段时间后未呈红色,说明铅蓄电池的A极为____极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g/cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________ mol。
②铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为__________L。
③消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)__________________________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂,附着力强,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广的应用。下面是一种醇酸树脂G的合成路线:

已知:RCH2=CH2
(1)反应①的反应条件为___________________,合成G过程中会生成另一种醇酸树脂,其结构简式为____________________________________
(2)反应②⑤反应类型分别为________、________;
(3)反应④的化学方程式为________;
(4)写出一种符合下列条件的F的同分异构体________。
a.1mol该物质与4mol新制氢氧化铜悬浊液反应
b.遇FeCl3溶液显紫色
c.核磁共振氢谱有3组峰值,比值为1:1:1
(5)设计由1一溴丙烷制备聚丙烯醇(![]() )的流程图:________。
)的流程图:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com