
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
| IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | Ar | ||||
(1)②的元素符号是_______
(2)①、⑤两种元素的原子半径大小关系:①__⑤(填“>”或“<”);
(3)③、④和⑤中,金属性最强的元素是____(填元素符号);
(4)⑤、⑥的最高价氧化物对应的水化物相互反应的离子方程式:____________。
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中医药科技创新和人类健康事业作出巨大贡献。我国化学家在确认青蒿素分子结构之后实现了青蒿素的全合成。根据信息(部分条件和步骤已省略)回答下列问题:
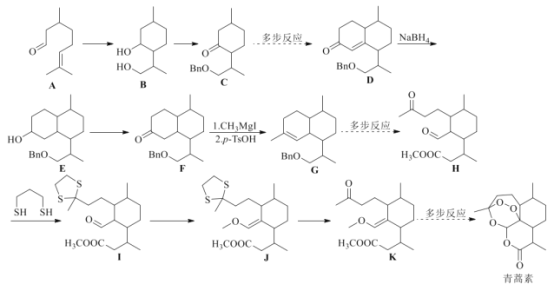
已知:![]() ,按要求回答下列问题:
,按要求回答下列问题:
(1)B的分子式为________________,所含官能团名称为________________________。![]() 的反应类型为________________。
的反应类型为________________。
(2)A的同系物中含碳原子数目最少的物质的结构简式为________________。A的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有________种,其中核磁共振氢谱峰数最少的物质的结构简式为________________。
(3)写出A与银氨溶液反应的化学方程式________________________________。
(4)通过![]() 的反应,分子中引入了硫醚基团,而
的反应,分子中引入了硫醚基团,而![]()
![]() 的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
(5)根据青蒿素所含官能团,推测其可能具有的性质________。
a.具有氧化性 b.可发生水解反应 c.易溶于水
(6)参照上述合成路线,写出以![]() 为主要原料,经四步反应制备
为主要原料,经四步反应制备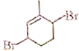 的流程。_____________
的流程。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
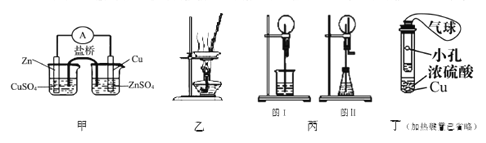
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
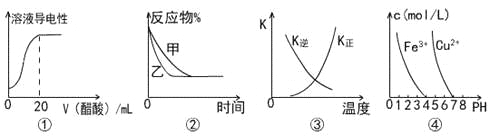
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关注营养平衡,促进身心健康。从下列四种物质中选择相应字母代号回答下列问题:
A 靑霉素 B 水 C 酱油 D 纤维素
①为最重要的抗生素,属于消炎药的是____;
②能刺激肠道蠕动,有助于食物消化的是___;
③为促进铁的吸收,我国选择作为铁强化食物的载体是___;
④属于人体的重要组成成分,每人每天要补充2.5~4.0L的是___。
(2)探索材料,丰富生活。请回答下列问题:
①家用菜刀的主要材质是用____;
A 铁合金 B 铝合金
②汽车轮胎的主要成分是___;
A 合成纤维 B 合成橡胶
③传统硅酸盐产品主要指____、陶瓷和水泥。
(3)保护生存环境,我们都在行动。请回答下列问题:
①正常雨水偏酸性,pH约为___;
②利用沉淀反应是除去水中重金属离子的常用方法。例如,向含Hg2+的废水中加入Na2S,可以使Hg2+转化为沉淀而除去。该反应的离子方程式为_____;
③我国《城市生活垃圾分类标志》中,代表回收标志的是_____;
A  B
B 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜别名一氯化铜为白色立方结晶或白色粉末,难溶于水,不溶于乙醇,在潮湿空气中易被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图。
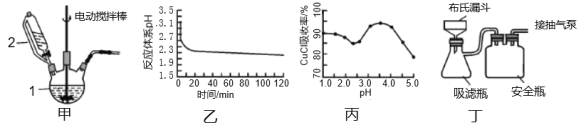
回答以下问题:
(1)甲图中仪器1的名称是___;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂为___(填“A”或“B”)
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式___;丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___,并维持pH在___左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是___(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2、和O2的含量。
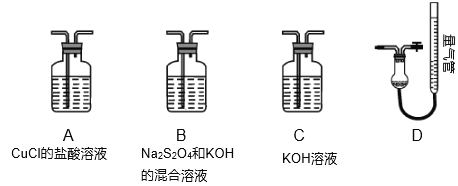
已知:Na2S2O4和KOH的混合液也能吸收氧气。
(4)装置的连接顺序应为___→D。
(5)用D装置测N2含量,读数时应注意___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CaO和HNO3为原料制备Ca(NO3)26H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
A.53.8%B.58.3%C.60.3%D.70.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出来的c水(H+)与 NaOH溶液的体积之间的关系如图所示。下列推断正确的是
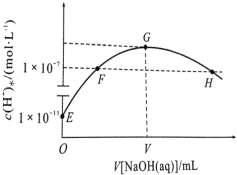
A.用 pH 试纸测定 E 点对应的溶液,其 pH=3
B.G 点对应的溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C.常温下加水稀释 H 点对应的溶液,溶液pH 减小
D.F、H 点对应的溶液中都存在:c(Na+) = c(Cl-) + c(ClO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com