
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 | 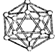 | 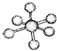 | 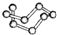 |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
分析 A.根据图B12结构单元解题;
B.SF6空间构型为对称结构分子极性抵消;
C.固态S8晶体中存在的微粒是S8分子,所以属于分子晶体;
D.碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>N>H.
解答 解:A.由图知,中间由六个B原子构成的正六边形,两边各3个B原子,共含有30个B-B键,含20个正三角形,故A正确;
B.不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,SF6空间构型为对称结构分子极性抵消,SF6为非极性分子,故B正确;
C.固态S8晶体中存在的微粒是S8分子,所以属于分子晶体,故C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,则结构式为H-C≡N,故D正确,故选C.
点评 本题主要考查比例模型和球棍模型,解题的关键是把握各原子间的成键情况,难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都可用锌制容器贮存 | B. | 常温下都能与铜较快反应 | ||
| C. | 露置于空气中,溶液质量均减轻 | D. | 露置于空气中,溶液浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
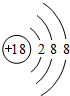 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
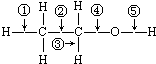 关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )| A. | 乙醇跟钠反应时,化学键④断裂 | |
| B. | 乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂 | |
| C. | 乙醇跟浓H2SO4共热到170℃时,化学键①④断裂 | |
| D. | 乙醇跟醋酸、浓H2SO4共热时,化学键④断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
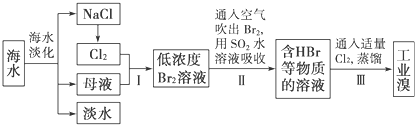

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com