
 全球气候变暖已经成为全世界人类面临的重大问题.
全球气候变暖已经成为全世界人类面临的重大问题.分析 (1)依据盖斯定律和热化学方程式计算得到所需的热化学方程式,利用热化学方程式的加减消去不需要的物质,注意加减时焓变随之变化;
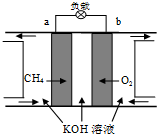
(2)①甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,总反应是燃料和氧气反应的化学方程式;
②根据电池的总反应确定酸碱性的变化;
③根据能量转化情况来回答.
解答 解:(1)①H2O(l)=2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ/mol
②CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
③12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol,
结合盖斯定律计算(①+②)×6+③得到绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式,
6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g)△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol;
则△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol,
即6CO2(g)+6H2O(l)=C6H12O6(葡萄糖、s)+6O2(g)△H=+2880 kJ•mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(葡萄糖、s)+6O2(g)△H=+2880 kJ•mol-1;
(2)①在碱性溶液中,正极氧气得电子被还原,电极方程式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
点评 本题考查较为综合,涉及热化学、电化学等问题,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度较大,注意把握电极方程式的书写以及盖斯定律的应用.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | a+b>c+d | ||
| C. | C的体积分数降低 | D. | B的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| C. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
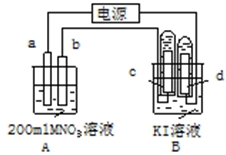 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
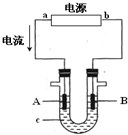 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由ZR组成的化合物为离子化合物 | B. | 含氧酸酸性R>X | ||
| C. | X、Y只能共存于共价化合物中 | D. | 原子半径Z>R>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数由少到多的顺序:X=W<Y<Z | |
| B. | 原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 元素非金属性由强到弱的顺序:X、Y、W | |
| D. | 元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com