
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高分析 (1)①Ti原子核外有22个电子,有1s、2s、2p、3s、3p、3d 7种能级,每一种能级存在一种能量的电子;
②BH4-中B原子价层电子对个数=4+$\frac{3+1-4×1}{2}$=4,且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型;
(2)A.NH3分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化类型;
B.原子个数相等、价电子数相同的微粒是等电子体;
C.CN-中每个原子含有一个孤电子对,且C、N原子间共用3个电子对;
D.氢化物的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高;
(3)①非极性分子的溶质易溶于非极性分子的溶剂;
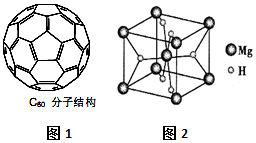
②根据图知,每个C原子σ键个数=$\frac{1}{2}$×3=1.5;
(4)①MgH2遇水就能释放H2,同时生成氢氧化镁;
②该晶胞中Mg原子个数=1+8×$\frac{1}{8}$=2,H原子个数为2+4×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{M}{{N}_{A}}×2}{ρ}$.
解答 解:(1)①Ti原子核外有22个电子,有1s、2s、2p、3s、3p、3d 7种能级,每一种能级存在一种能量的电子,所以Ti的基态原子7种能量不同的电子,
故答案为:7;
②BH4-中B原子价层电子对个数=4+$\frac{3+1-4×1}{2}$=4,且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型为正四面体,故答案为:正四面体;
(2)A.NH3分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化类型为sp3杂化,故A正确;
B.原子个数相等、价电子数相同的微粒是等电子体,二者原子个数不相等,所以不是等电子体,故B错误;
C.CN-中每个原子含有一个孤电子对,且C、N原子间共用3个电子对,所以其电子式为 ,故C正确;
,故C正确;
D.氢化物的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高,氨气中含有氢键、磷化氢中不含氢键,所以氨气熔沸点高于磷化氢,故D正确;
故选ACD;
(3)①非极性分子的溶质易溶于非极性分子的溶剂,苯和二硫化碳都是非极性分子,C60晶体易溶于苯、CS2,说明C60是非极性 分子,故答案为:非极性;
②根据图知,每个C原子σ键个数=$\frac{1}{2}$×3=1.5,则C60分子中含有σ键数目=1.5×60=90,
故答案为:90;
(4)①MgH2遇水就能释放H2,同时生成氢氧化镁,反应方程式为MgH2+2H2O═Mg(OH)2+2H2↑,
故答案为:MgH2+2H2O═Mg(OH)2+2H2↑;
②该晶胞中Mg原子个数=1+8×$\frac{1}{8}$=2,H原子个数为2+4×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{M}{{N}_{A}}×2}{ρ}$=$\frac{\frac{26}{{N}_{A}}×2}{a}$cm3=$\frac{52}{a{N}_{A}}$cm3,
故答案为:$\frac{52}{a{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、原子核外电子排布等知识点,明确物质结构、原子结构是解本题关键,侧重考查学生分析计算及空间想象能力,难点是晶胞计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{112}$Cd原子的中子数为64 | |
| B. | 聚氯化铝能降污是因为它有强氧化性 | |
| C. | 聚氯化铝是混合物 | |
| D. | 镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com