
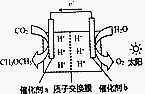
 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
分析 依据这装置图中电子流向可知催化剂a电极为正极,催化剂b电极为负极,正极上二氧化碳得到电子分析还原反应生成甲醚,水失电子发生氧化反应生成氧气,原电池中阳离子移向正极,能量变化是太阳能转化为化学能转化为电能,依据电子守恒计算电极上消耗二氧化碳和生成氧气物质的量之比.
解答 解:依据这装置图中电子流向可知催化剂a电极为正极,催化剂b电极为负极,正极上二氧化碳得到电子分析还原反应生成甲醚,水失电子发生氧化反应生成氧气,原电池中阳离子移向正极,能量变化是化学能转化为电能,依据电子守恒计算电极上消耗二氧化碳和生成氧气物质的量之比,
A.分析可知原电池中阳离子移向正极,H+由交换膜右侧向左侧迁移,故A正确;
B.催化剂a表面发生的反应是二氧化碳得到电子在酸性溶液中生成甲醚,电极反应是2CO2+12e-+12H+═CH3OCH3+3H2O,故B正确;
C.模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),该过程是太阳能转化为化学能的过程,故C正确;
D.原电池中电子守恒,CO2~CH3OCH3~6e-,O2~H2O~4e-,2CO2~3O2~12e-,则消耗CO2与生成O2体积比为2:3,故D错误;
故选D.
点评 本题考查了常见能量的变化分析,原电池原理的理解应用,主要是电极反应,电子守恒的计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
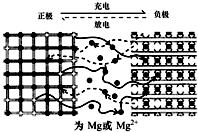 镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )
镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )| A. | 放电时,电池中的Mg2+从负极移向正极 | |
| B. | 其负极反应为:xMg-2xe-+Mo3S42x-═MgxMo3S4 | |
| C. | 充电时阳极反应式:MgxMo3S4-2xe-═Mo3S4+xMg2+ | |
| D. | 由于镁的密度较小,且Mg2+携带两个正电荷,这为高能量电池的设计提供了一个可靠依据 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com