
【题目】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3++2Ag![]() Tl++2Ag+,下列推断正确的是( )
Tl++2Ag+,下列推断正确的是( )
A.Tl+的最外层有1个电子B.Tl能形成+3价和+1价的化合物
C.Tl3+氧化性比铝离子弱D.Tl+的还原性比Ag强
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组选用下列装置,利用反应![]() ,通过测量生成水的质量
,通过测量生成水的质量![]() 来测定Cu的相对原子质量。实验中先称取氧化铜的质量
来测定Cu的相对原子质量。实验中先称取氧化铜的质量![]() 为a g。
为a g。
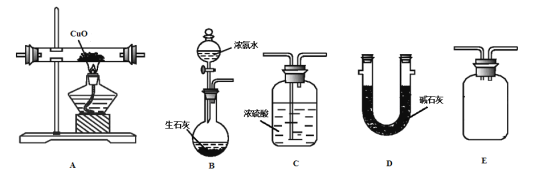
(1)浓氨水滴入生石灰中能制得NH3的原因是______________。
(2)甲同学按B-A-E-C-D的顺序连接装置,该方案是否可行__________,理由是_______________。
(3)乙同学按B-A-D-E-C的顺序连接装置,则装置C的作用是___________________________。
(4)丙同学认为乙同学测量的![]() 会偏高,理由是_____,你认为该如何改进?___
会偏高,理由是_____,你认为该如何改进?___
(5)若实验中测得![]() g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
(6)若CuO中混有Cu,则该实验测定结果_________。(选填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() (a).
(a). ![]() (b).
(b). ![]() (c)的分式均为C5H6,下列有关叙述正确的是
(c)的分式均为C5H6,下列有关叙述正确的是
A. 符合分子式为C5H6的同分异构体只有a、b、c三种
B. a、b、c的一氯代物都只有三种
C. a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D. a、b、c分子中的5个碳原子一定都处于同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
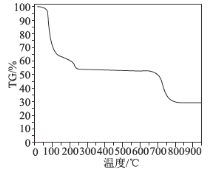
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.6.2g白磷分子(P4)中含P-P键数为0.05NA
B.1mol CH3+含电子数为8NA
C.标准状况下,22.4LSO3中含原子数为4NA
D.常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A. ①④⑤⑥B. ②③⑥C. ②④⑤⑥D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应生成的羟基自由基(·OH) 能氧化降解有机污染物。下列说法正确的是

A. 电源的X极为正极
B. 与电源Y相连电极的电极反应式为H2O+e-=H++·OH
C. Fenton反应: H2O2+Fe2+=Fe(OH)2++·OH
D. 每消耗22.4L O2 (标准状况),整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com