
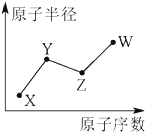
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
分析 X、Y、Z、W是四种常见的短周期主族元素,Y是形成化合物种类最多的元素,则Y为C元素;X的原子序数和半径均不C小,所以X为H元素;Z与X可形成两种常温下液态的化合物,可推知Z为O;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;结合元素化合物性质解答.
解答 解:X、Y、Z、W是四种常见的短周期主族元素,Y是形成化合物种类最多的元素,则Y为C元素;X的原子序数和半径均不C小,所以X为H元素;Z与X可形成两种常温下液态的化合物,可推知Z为O;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;
A.C、O、Cl三种元素,可以形成CO、CO2、CCl4、ClO2等化合物,故A错误;
B.H、C、O三种元素,可以形成很多种有机物和无机物,所以形成的化合物超过8种,故B正确;
C.C的含氧酸的酸性可能大于Cl的含氧酸的酸性,如H2CO3>HClO,故C错误;
D.1molX、Y两种元素形成的化合物有多种,如CH4、C2H4等,1molC2H4完全燃烧消耗3mol氧气,故D错误.
故选B.
点评 本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用,侧重于考查学生的分析能力和对基础知识的应用能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
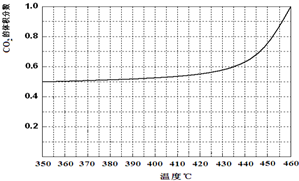
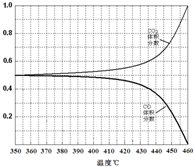 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X-衍射实验可以区分晶体和非晶体 | B. | SiO2属于原子晶体 | ||
| C. | 金属钋是简单立方堆积 | D. | 晶格能的大小只与离子半径有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
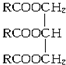 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
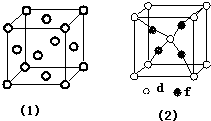 周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;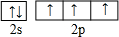 ,f在周期表中的位置是第四周期第IB族
,f在周期表中的位置是第四周期第IB族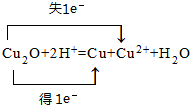 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.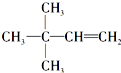 或
或 或
或 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com