
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 2 |
| 2×32 |
| 1 |
| 9 |
| 1 |
| 2 |
| 0.005mol×2 |
| 4 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
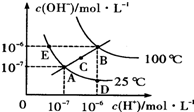
| A、图中五点KW间的关系B>C>A=D=E |
| B、若从A点到D点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的氢氟酸溶液加水稀释,平衡正向移动,溶液中各离子浓度均减小 |
| B、pH=2的盐酸酸化的FeCl3溶液,稀释10倍后,溶液pH=3 |
| C、在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| D、在25℃时,任何水溶液中KW=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焰色反应时一定发生化学变化 |
| B、KC1与明矾灼烧时火焰颜色相同 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、所有金属及其化合物灼烧时,火焰均有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
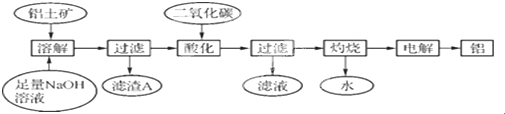
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com